 巴中高三学生辅导文化课有哪些学校推荐
巴中高三学生辅导文化课有哪些学校推荐 【新学高考艺考生文化课补习班教学计划】
一、注重基础知识训练
教研老师会帮助学生将3年的知识总结归纳与更新,将解题的技巧和方法传授给学生,督促学生熟记所有的知识点。
二、提升弱项科目
新学高考做高考补习多年,深知每一个学生都是不同的个体,每个学生的学科问题都是不一样的,所以我们得老师会做到因教施材,尊重个体的差异化,尽全力让每个同学的成绩在原有的基础上都有大幅度提高。
三、培养学生良好习惯
良好的学习习惯是提升成绩的前提,让学生学会主动学习,自己学会制定学习计划,是我们对每一个学生的要求。
新学高考师资介绍
大家可能会问新学高考的师资怎么样?
老师都是从哪里来的?
教龄多少了?
对于大家关心的以上各种问题,新学高考给大家的回答是:请您放心,新学高考的各科各级老师都是我们通过层层筛选,进行多次估量考核,结合各方面的情况选拔出来的老师。
我们的老师有的是重点公立学校聘请的,也有各大重点大学招聘的,关于专业度,你大可放心,教龄也是至少从事过三年高考辅导的。
 巴中高三学生辅导文化课有哪些学校推荐
巴中高三学生辅导文化课有哪些学校推荐 孩子学习不上心,成绩也一直落后,想着学校的管理也不怎么好,一个老师也管不了那么多学生,抱着试试的心态就在外面给孩子找全日制的补习机构,找了几家,后面还是觉得新学高考好,不光是全日制,还是封闭式管理,就直接让孩子在新学高考读一年。
这里的环境还挺好的,老师对学生很关心,孩子也觉得这里有浓厚的学习氛围,让他慢慢的爱上了学习。对学校总的办学质量还是很满意的,老师们教学认真负责,及时与家长沟通联系,使家长能及时了解孩子在校的表现。谢谢各位老师认真负责的教育和教学,让孩子到校后有了很多进步,所以我很相信这里的老师,家长和学生共同教育孩子,让孩子的成绩越来越好。
上了几次课,感觉这里的老师水平很不错的,老师的教学方法有趣新颖,孩子们特别喜欢,课下老师也注重跟我们家长间的交流,告诉我们孩子在课上的状态和表现,光是这几节课我发现孩子的学习态度明显变得比以前积极了,感谢新学的老师们对孩子的关心。
 巴中高三学生辅导文化课有哪些学校推荐
巴中高三学生辅导文化课有哪些学校推荐 1、已知:①2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
②K2Cr2O7+14HCl→2KCl+2CrCl3+3Cl2↑+7H2O
③MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(大于6mol•L﹣1)反应,MnO2需和浓盐酸反应(大于8mol•L﹣1)反应.根据以上信息,下列叙述不正确的是( )
A.上述各反应均既属于氧化还原反应,有属于离子反应
B.氧化性:KMnO4>K2Cr2O7>Cl2>MnO2
C.盐酸的浓度越大,Cl﹣的还原性越强
D.每生成1molCl2,上述各反应转移的电子数均为2NA(NA为阿伏加德罗常数的值)
【知识点】氧化还原反应
【答案】
【考点】氧化还原反应.
【专题】氧化还原反应专题.
【分析】A.化学反应中有元素化合价变化的属于氧化还原反应,有离子参加的化学反应是离子反应;
B.在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
C.盐酸的浓度越大,氯离子的还原性越强;
D.根据化合价变化判断.
【解答】解:A.这三个分子中都有元素化合价变化,且都有离子参加,所以既属于氧化还原反应又属于离子反应,故A正确;
B.MnO2+4HCl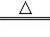
 MnCl2+Cl2↑+2H2O中二氧化锰的氧化性大于氯气,故B错误;
MnCl2+Cl2↑+2H2O中二氧化锰的氧化性大于氯气,故B错误;
C.盐酸的浓度越大,氯离子的浓度越大,其反应速率越快,则氯离子的还原性越强,故C正确;
D.生成1 mol Cl2转移电子数均为2[0﹣(﹣1)]NA=2 NA,故D正确
故选B.
【点评】本题考查氧化还原反应,明确氧化还原反应的实质是解本题关键,难度不大.
2、当光束通过下列分散系时,能产生丁达尔现象的是( )
A.Fe(OH)3胶体B.氯化钠溶液C.盐酸D.硫酸
【知识点】电化学 胶体
【答案】
【考点】分散系、胶体与溶液的概念及关系.
【分析】丁达尔效应是指:当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路.丁达尔现象是胶体特有的性质,抓住这一特点即可解答.
【解答】解:A.Fe(OH)3胶体分散质微粒直径在1﹣100nm之间是胶体,有丁达尔效应,故A正确;
B.氯化钠溶液分散质微粒直径小于1nm是溶液,没有丁达尔效应,故B错误;
C.盐酸溶液分散质微粒直径小于1nm是溶液,没有丁达尔效应,故C错误;
D.硫酸溶液分散质微粒直径小于1nm是溶液,没有丁达尔效应,故D错误.
故选A.
3、对已达化学平衡的下列反应:2X(g)+Y(g)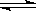 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动[]
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
【知识点】化学反应速率
【答案】
C











