 四川成都音乐生文化课集训机构哪里好
四川成都音乐生文化课集训机构哪里好 【新学高考优势】
新学高考专注高考教育多年,在高考应试教育方面有着非常丰富的经验,学校设有专业教研团队,分析历年高考试卷,总结高考知识点、重点考试范围,让学生真正掌握知识点,并在短时间内实现大幅度提分。
新学高考艺考生中心管理模式
新学高考五年来专注于高考文化课辅导,对于高考失利的艺考生来说,在这里是体会着全日制封闭式管理,学生吃住一体化,每个班级配有专职班主任全天跟踪管理,让学生有更多的精力学习。
 四川成都音乐生文化课集训机构哪里好
四川成都音乐生文化课集训机构哪里好 校区环境很好,主要是卫生干净,教室透风,光线很好,在校区呆着上课不压抑,没有闷的感觉。班主任老师很负责,每天上完课都会反馈孩子的学习情况,上课老师孩子很喜欢,上课有激情,非常幽默,学习了两个月,学习态度有很大的变化。
我是今年从新学高考毕业的学生,现在已经是一名大学生了,想想那段在新学补习的日子,是真的很痛苦,每天老师催着看书,写作业,多早就要起来上自习,不过现在也很感谢他们,就是因为他们的严格要求,高考才考出了满意的成绩。
我就是一个典型的差等生,家里人让我过来冲刺一下,本以为都已经这样了,现在再怎么补习都来不及了,没想到,才来听了几天的课,就有种开窍的感觉,这边老师讲课的方式跟我很搭,跟着老师的思路走,学着学着就听懂了。
 四川成都音乐生文化课集训机构哪里好
四川成都音乐生文化课集训机构哪里好 1、在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如表:下列说法正确的是( )
| | 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.T1时0~10 min NO2的平均反应速率为0.15 mol•L﹣1•min﹣1
B.T2时CH4的平衡转化率为70.0%
C.保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
【知识点】化学反应速率 化学平衡
【答案】
【分析】A.结合v=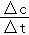 及速率之比等于化学计量数之比计算;
及速率之比等于化学计量数之比计算;
B.由表格数据可知,T2时CH4的平衡物质的量为0.15mol,则转化的甲烷为0.50mol﹣0.15mol=0.35mol;
C.T1时,体积为1L,由表格中数据可知,
CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)
开始 0.5 1.2 0 0 0
转化 0.4 0.8 0.4 0.4 0.8
平衡 0.1 0.4 0.4 0.4 0.8
K=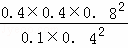 =6.4,
=6.4,
T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),比较Qc、K,判断反应进行方向;
D.体积不变,物质的量变为原来的2倍,若平衡不移动,则平衡浓度变为原平衡的2倍,但压强增大平衡逆向移动.
【解答】解:A.T1时0~10 min CH4的平均反应速率为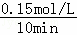 =0.015 mol•L﹣1•min﹣1,由速率之比等于化学计量数之比可知,T1时0~10 min NO2的平均反应速率为0.03 mol•L﹣1•min﹣1,故A错误;
=0.015 mol•L﹣1•min﹣1,由速率之比等于化学计量数之比可知,T1时0~10 min NO2的平均反应速率为0.03 mol•L﹣1•min﹣1,故A错误;
B.由表格数据可知,T2时CH4的平衡物质的量为0.15mol,则转化的甲烷为0.50mol﹣0.15mol=0.35mol,则T2时CH4的平衡转化率为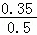 ×100%=70.0%,故B正确;
×100%=70.0%,故B正确;
C.T1时,体积为1L,由表格中数据可知,
CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)
开始 0.5 1.2 0 0 0
转化 0.4 0.8 0.4 0.4 0.8
平衡 0.1 0.4 0.4 0.4 0.8
K=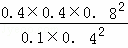 =6.4,
=6.4,
T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),Qc=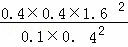 =25.6>K,则平衡逆向移动,故C错误;
=25.6>K,则平衡逆向移动,故C错误;
D.体积不变,物质的量变为原来的2倍,若平衡不移动,则平衡浓度变为原平衡的2倍,但压强增大平衡逆向移动,则达新平衡时N2的浓度增大,大于原平衡浓度小于原平衡浓度的2倍,故D正确;
故选:BD。
【点评】本题考查化学平衡的计算,为高频考点,把握表格中数据、平衡三段法、Qc与K的计算为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大.
2、合金比纯金属的性能更优良,应用范围更广,下列材料不是合金的是
A.黄铜 B.合金钢 C.硬铝 D. 金箔
【知识点】金属的冶炼
【答案】
D
3、运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
【知识点】化学反应速率 化学平衡
【答案】
D [解析] 当ΔH-TΔS<0时,反应能自发进行,吸热反应的ΔH>0,吸热反应能自发,说明ΔS>0,A项正确;NH4F溶液中F-水解生成HF,HF能与玻璃中的SiO2发生反应4HF+SiO2===SiF4↑+2H2O,故NH4F溶液不能存放在玻璃试剂瓶中,B项正确;可燃冰需在低温高压下形成,所以可燃冰可存在于海底,C项正确;常温下,浓硫酸使铁发生钝化,D项错误。











