 广元艺考生培训文化课有哪些机构推荐
广元艺考生培训文化课有哪些机构推荐 教学方法:
配合TLE教学法。新学高考从考生心理、学习情况、身心健康、掌握程度等全方位优化其学习方法,激发艺考生学习斗志,让考生调整好心态,从容面对高考。战胜高考前的重重阻碍
新学高考师资介绍
大家可能会问新学高考的师资怎么样?
老师都是从哪里来的?
教龄多少了?
对于大家关心的以上各种问题,新学高考给大家的回答是:请您放心,新学高考的各科各级老师都是我们通过层层筛选,进行多次估量考核,结合各方面的情况选拔出来的老师。
我们的老师有的是重点公立学校聘请的,也有各大重点大学招聘的,关于专业度,你大可放心,教龄也是至少从事过三年高考辅导的。
 广元艺考生培训文化课有哪些机构推荐
广元艺考生培训文化课有哪些机构推荐 有些学校不得不说是非常坑人的,是以赚钱为目的的,大部分是一锤子买卖。这里给大家推荐一所学校--新学高考,他们因材施教,根据高三学生的情况制定学习方案。
我们之前就是听说新学高考的老师上课上的不错,就过去读了,读的过程中,我发现还真的是,娃娃每回考试的成绩都在上升,有时候上升的慢,不过我也满意。
娃娃现在上高三,成绩一般,怕他考不上大学,同事让我给孩子找个补习班,她的孩子去年就在新学高考学习,说新学高考的教学还不错,老师对待教学认真负责,上课条理清晰,对学生严格要求,能够鼓动学生踊跃发言,学生的学习氛围也积极,带孩子去了解了,也已经报名了。
 广元艺考生培训文化课有哪些机构推荐
广元艺考生培训文化课有哪些机构推荐 1、用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是( )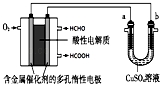
A.当a、b都是铜做电极时,电解的总反应方程式为:2CuSO4+2H2O  2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B.燃料电池工作时,正极反应为:O2+2H2O+4e﹣═4 OH﹣
C.当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e﹣
D.燃料电池工作时,负极反应为:HCHO+H2O﹣2e﹣═HCOOH+2H+
【知识点】电化学 胶体
【答案】
【考点】化学电源新型电池.
【分析】左边装置是酸性甲醛燃料电池,原电池放电时,燃料失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂的电极为正极,正极上氧化剂得电子发生还原反应,由于电解质溶液呈酸性,正极反应为:O2+4e﹣+4H+=2H2O;右边装置有外接电源,所以是电解池,连接负极的a电极是阴极,连接正极的b电极是阳极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应.
【解答】解:A.当a、b都是铜做电极时,形成电解精炼装置,阳极Cu失电子,阴极上铜离子得电子,故A错误;
B.由于电解质溶液呈酸性,正极反应为:O2+4e﹣+4H+=2H2O,故B错误;
C.当燃料电池消耗2.24L甲醛气体时,由于没有说明是标准状况下,所以无法计算甲醛的物质的量,则无法计算转移的电子的物质的量,故C错误;
D.燃料电池工作时,甲醛在负极上失电子生成甲酸,则负极反应为:HCHO+H2O﹣2e﹣═HCOOH+2H+,故D正确;
故选D.
【点评】本题考查原电池和电解池知识,侧重于学生的分析能力的考查,题目难度中等,注意电解质的酸碱性对电极反应的影响为解答该题的关键.
2、下列实验中,对应的现象以及结论都正确且两者具有因果关系是( )
| 选项 | 实验 | 现象 | 结论 |
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B. | 将铜粉加入1.0mol·L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色 固体出现 | 金属铁比铜活泼 |
| C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D. | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
【知识点】金属元素的单质及其化合物
【答案】
D
3、已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2﹣的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO3﹣+2Ca2++4OH﹣═Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S═CuS↓+2H+
C.Zn2++S2﹣+2H2O═Zn(OH)2↓+H2S↑
D.FeS+2H+═Fe2++H2S↑
【知识点】电离平衡
【答案】
【考点】难溶电解质的溶解平衡及沉淀转化的本质;离子方程式的书写.
【专题】离子反应专题;电离平衡与溶液的pH专题.
【分析】溶液中的离子总是优先结合成更难溶或更难电离的物质,因ZnS比Zn(OH)2难溶,故C项中的S2﹣和Zn2+应先结合成ZnS沉淀,而不是双水解.
【解答】解:A.由于溶解度MgCO3>Mg(OH)2,则反应生成Mg(OH)2和CaCO3,故A正确;
B.由于电离出S2﹣的能力H2S>CuS,则Cu2+与H2S反应生成CuS,离子方程式正确,故B正确;
C.因ZnS比Zn(OH)2难溶,S2﹣和Zn2+应先结合成ZnS沉淀,而不是双水解,故C错误;
D.由于电离出S2﹣的能力FeS>H2S,FeS溶于酸可生成H2S,故D正确.
故选:C.
【点评】本题为信息应用题,考查考生对新信息的应用能力,题目难度中等,易错点为A,也是常考查的地方,学习中注意.












