 广安高三文化课冲刺班哪里好
广安高三文化课冲刺班哪里好 新学高考艺考生优势
一、全面的服务体系,为学生配备24小时班主任,心理师以及学习答疑教师
二、优质师资,多年从教经验帮助每一位艺考生抓住答题关键,与细节丢分说拜拜
三、良好的学习环境,学校备有干净明亮的宿舍和健康卫生的食堂环境,让学生专心,家长放心
【新学高考管理制度】
严格的封闭式管理,安静整洁的教学环境,营造良好的学习氛围,使学生能够静心学习,有效提高。学生在学校期间,手机、电脑一律由学校统一保管,每周日发放给学生用于与家长联系;可以远离不良性学生的影响,杜绝网瘾。
 广安高三文化课冲刺班哪里好
广安高三文化课冲刺班哪里好 这个学校真的很棒,不管是学习,教学计划,衣食住行,管理都非常的严格,不管孩子多贪玩的心都收拾的服服帖帖的。老师们教学也很福足额,学习氛围很强烈,每周每月都有测评,每天还会反馈学习情况给家长。
新学高考是一家非常不错的教育培训机构。只是之前学习成绩一直不太理想,尤其是数学这方面非常的薄弱,刚好我有同班同学就是在新学高考补习的。后来我也去了这所学校,入校前,老师针对我的学习进行了非常详细的分析,后面授课老师帮我构建了完整的知识体系,现在我的进步很明显,特别是我的数学成绩。
看大家近都在问新学高考好不好,作为一个在新学高考读过书的学生来说,学校挺好,毕竟他们只做高三的课程,没有其他的什么小学补习,初中补习之类的,他们的教学计划都是根据学生个人情况指定的,让学生有一个好的学习计划,不盲目学习,这样能抓住重点,所以新学高考还是很好的。
 广安高三文化课冲刺班哪里好
广安高三文化课冲刺班哪里好 1、Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
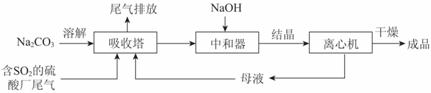
(1)举例说明向大气中排放SO2导致的环境问题:_________。
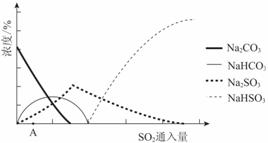
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的佳操作是_________(选填字母)。
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95 ~100℃加热浓缩,冷却至室温结晶
~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是: IO3-+
IO3-+ SO32- =
SO32- = _______ +
_______ + _______(将方程式补充完整)
_______(将方程式补充完整)
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
【知识点】化学反应及及其能量变化
【答案】
(1)酸雨(2)2CO32- + SO2 + H2O = 2HCO3- + SO32-(3)NaHSO3 + NaOH = Na2SO3 + H2O
(4)①Na2SO3存在溶解平衡:N a2SO3(s)
a2SO3(s) 2Na+ (aq) + SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动;②b;(5)BaCl2溶液稀盐酸
2Na+ (aq) + SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动;②b;(5)BaCl2溶液稀盐酸
 (6)①
(6)① IO3- +
IO3- +  SO32- =
SO32- = 
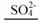 +
+ 
 ;②3xy×100%
;②3xy×100%
2、反应2NO+2CO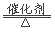 N2+2CO2可应用于汽车尾气的净化。下列判断正确的是( )
N2+2CO2可应用于汽车尾气的净化。下列判断正确的是( )
A.该反应是置换反应 B.该反应是复分解反应
C.碳元素化合价降低 D.该反应是氧化还原反应
【知识点】氧化还原反应
【答案】
D
3、物质的量相同的甲烷和氨气,一定相等的是
A.体积  B.质量
B.质量  C.质子数 D.原子数
C.质子数 D.原子数
【知识点】物质的量
【答案】
C













