 广汉传媒生文化课补习学校推荐
广汉传媒生文化课补习学校推荐 新学高考优势:
优势一:全西南优质的教师团队。老师都是有多年高三教学经验的一线科任老师,可以有效保证学生快速提分,为学生高考保驾护航。
优势二:入学签订辅导协议,15天不满意全额退费。
优势三:军事化全封闭式管理模式,学生的衣食住行统一安排。
优势四:2对1(一个班配备两个班主任),24小时守护,保证人身安全。
【新学高考管理制度】
新学高考拥有行业高水平的班主任团队,在管理学员方面,根据孩子的特质,采用个性化的管理模式,一对一解决孩子的学习问题,无论是生活上还是学习上都能让孩子得到明显改善!
 广汉传媒生文化课补习学校推荐
广汉传媒生文化课补习学校推荐 新学高考是一家坐落在主城区的正规培训机构。和其他机构不一样的是,他们不开设中小学补习课程。新学高考多年来只专注于高考辅导,如果您的孩子是高三应届生,是艺考生需要冲刺文化课,都可以去校区详细了解。
我家弟弟准备升大学了,但是成绩一直不怎么理想。家里也很愁,怕这个成绩没法上到好大学,影响今后发展。刚好有人介绍有这家补习机构不错,我们先大概了解了一下里面学习氛围很浓厚,老师讲解耐心认真,弟弟也非常喜欢老师的教学模式的。全家都挺满意!
来了这里,接待的老师很亲切。仔细询问学生的情况。然后又一一介绍了班级,感觉挺温馨的。上课的老师感觉很风趣幽默,讲知识也很全面,我基础不是特别好,但是上课几乎都能听懂。准备介绍给我朋友,带着他们一起来!
 广汉传媒生文化课补习学校推荐
广汉传媒生文化课补习学校推荐 1、下列关于离子的叙述正确的是( )
| | A. | 在c(H+)=1×10﹣13mol•L﹣1的溶液中:Na+、Fe3+、Cl﹣、SO42﹣能大量共存 |
| | B. | 铜溶于FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+ |
| | C. | NaHCO3溶液中:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) |
| | D. | 向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42﹣ |
【知识点】电离平衡 水解平衡
【答案】
考点:
离子共存问题;离子方程式的书写;离子浓度大小的比较;硫酸根离子的检验.. | | 分析: | A.该溶液为碱性溶液,铁离子与氢氧根离子反应生成氢氧化铁沉淀; B.离子方程式两边正电荷不相等,不满足电荷守恒; C.根据碳酸氢钠溶液中的物料守恒判断; D.原溶液中可能存在银离子,不一定存在硫酸根离子. |
| 解答: | 解:A.在c(H+)=1×10﹣13mol•L﹣1的溶液中存在大量氢氧根离子,Fe3+、OH﹣之间发生反应生成氢氧化铁沉淀,在溶液中不能大量共存,故A错误; B.铜溶于FeCl3溶液中生成亚铁离子和铜离子,正确的离子方程式为:Cu+2Fe3+=2Fe2++Cu2+,故B错误; C.NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),故C正确; D.向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,该白色沉淀可能为氯化银,原溶液中可能存在银离子,不一定含有SO42﹣,故D错误; 故选C. |
| 点评: | 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等. |
2、常温下,向10 mL b mol·L-1的CH3COOH溶液中滴加等体积的0.01 mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法不正确的是( )
A.b>0.01
B.混合后溶液呈中性
C.CH3COOH的电离常数Ka=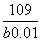
D.向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
【知识点】电离平衡单元测试
【答案】
D
3、常温下,下列溶液中离子浓度关系表达正确的是( )
A.Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO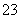 )+c(HCO
)+c(HCO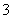 )
)
B.0.1 mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH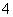 )>c(OH-)
)>c(OH-)
C.向NH4HSO4的水溶液中逐滴滴入NaOH溶液,至中性的溶液中:c(Na+)>c(SO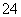 )>c(NH
)>c(NH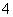 )>c(H+)=
)>c(H+)=
c(OH-)
D.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(Na+)>c(CH3COO-)>
c(OH-)>c(H+)
【知识点】盐类的水解
【答案】
【答案】C
【解析】根据电荷守恒得c(H+)+c(Na+)=c(OH-)+2c(CO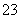 )+c(HCO
)+c(HCO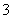 ),故A错误;氯化铵是强酸弱碱盐,溶液呈酸性,铵根离子能水解,但程度较小,所以存在c(Cl-)>c(NH
),故A错误;氯化铵是强酸弱碱盐,溶液呈酸性,铵根离子能水解,但程度较小,所以存在c(Cl-)>c(NH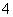 )>c(H+)>c(OH-),故B错误;如果两者以1∶1反应,溶液中的溶质是硫酸钠、硫酸铵,溶液呈酸性,要使溶液呈中性,则氢氧化钠稍微过量,铵根离子水解,所以溶液中离子浓度大小顺序是c(Na+)>c(SO
)>c(H+)>c(OH-),故B错误;如果两者以1∶1反应,溶液中的溶质是硫酸钠、硫酸铵,溶液呈酸性,要使溶液呈中性,则氢氧化钠稍微过量,铵根离子水解,所以溶液中离子浓度大小顺序是c(Na+)>c(SO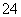 )>c(NH
)>c(NH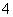 )>c(H+)=c(OH-),故C正确;pH=3的醋酸溶液浓度大于pH=11的氢氧化钠溶液浓度,两者等体积混合,醋酸有剩余,溶液呈酸性,则
)>c(H+)=c(OH-),故C正确;pH=3的醋酸溶液浓度大于pH=11的氢氧化钠溶液浓度,两者等体积混合,醋酸有剩余,溶液呈酸性,则
c(OH-)<c(H+),故D错误。











