 宜宾艺考文化课集训学校排名
宜宾艺考文化课集训学校排名 新学高考优势
一、名师领衔执教---持证教学,担责教学,全面提升
二、一对一精细辅导,针对学生薄弱点制定个性辅导方案,增强补弱
三、班型精品定制,根据学生学习情况选择合适的班型,辅导老师随叫随到
【新学高考师资介绍】
新学高考拥有高素质的专职教师队伍,教学老师都具备丰富的高考教学经验和高超的课堂驾驭能力,学校除了严把教师应聘关,更加注重教师的日常教学管理
 宜宾艺考文化课集训学校排名
宜宾艺考文化课集训学校排名 新学高考是专门做高考补习的一个学校,对基础差的学生很有帮助,我孩子就是来的时候只有300分,今年高考考了470,走了个本科,我后面还要给别人推荐这个学校。
朋友推荐过来新学高考学习,这里的老师很负责,也很专业,这次一诊下来,孩子的数学也由之前的80多分提到了110,我很感谢唐老师。距离高考也没多长时间了,我很放心的把孩子交给新学高考的老师,也希望孩子能坚持下去,有更大的进步!
孩子在这学了快2个月了,之前英语一直及不了格在张老师的辅导下这次月考了105,孩子得知成绩后非常开心,我觉得一切都值了。期中考试定了上110的小目标,不管考下结果怎样,看到他学习习惯的转变,对学习兴趣的提升,作为父母的我们,还是非常欣慰。
 宜宾艺考文化课集训学校排名
宜宾艺考文化课集训学校排名 1、下列实验不能达到实验目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 测定相同物质的量浓度的KOH和氨水的pH | 证明氨水中存在电离平衡 |
| B | 向混有NaCl的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 将Mg、Al和NaOH溶液设计为原电池 | 比较Mg、Al活泼性强弱 |
| D | 用惰性电极电解饱和食盐水,阴极附近滴加酚酞 | 验证阴极有碱生成 |
【知识点】电离平衡单元测试
【答案】
C
2、设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A.1mol醋酸的质量与NA个醋酸分子的质量相等
B.NA个氧分子和NA个氮分子的质量比等于8:7
C.28g氮气所含的原子数目为NA
D.在标准状况下,0.5NA个氯气分子所占体积约是11.2L
【知识点】物质的量单元测试
【答案】
【考点】阿伏加德罗常数.
【专题】阿伏加德罗常数和阿伏加德罗定律.
【分析】A、NA个即为1mol,m=n×M;
B、NA个即为1mol,利用m=n×M来计算质量比;
C、氮气为双原子构成的分子;
D、标准状况下,Vm=22.4L/mol,V=n×Vm.
【解答】解:A、NA个即为1mol,由m=n×M可知,1mol醋酸的质量与NA个醋酸分子的质量相等,故A正确;
B、NA个氧分子和NA个氮分子的质量比等于1mol×32g/mol:1mol×28g/mol=8:7,故B正确;
C、氮气的物质的量为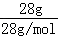 =1mol,所含的原子数目为2NA,故C错误;
=1mol,所含的原子数目为2NA,故C错误;
D、在标准状况下,0.5NA个氯气分子,其物质的量为0.5mol,则体积为0.5mol×22.4L/mol=11.2L,故D正确;
故选C.
【点评】本题考查阿伏加德罗常数,题目难度不大,注意物质的组成、结构、性质和存在条件是否标准状态以及物质的聚集状态等问题,解答此类题目时,常从以上几个角度考虑.
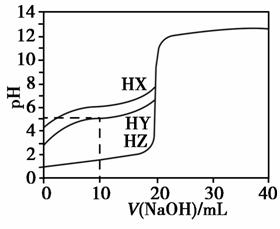
3、25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)= +c(Z-)+c(OH-)
+c(Z-)+c(OH-)
【知识点】电离平衡单元测试
【答案】
解析:根据中和滴定曲线先判断HX、HY和HZ的酸性强弱,再运用电离平衡、水解平衡知识分析、解决相关问题。
由图像可知,当V(NaOH)=0(即未滴加NaOH)时,等浓度的三种酸溶液的pH大小顺序为HX>HY>HZ,则酸性强弱顺序为HX<HY<HZ,相同条件下三种酸溶液的导电能力顺序为HX<HY<HZ,A项错。当V(NaOH)=10 mL时,HY溶液中c(H+)=10-5mol·L-1,c(OH-)=10-9mol·L-1,c(Na+)=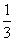 ×0.1000 mol·L-1,据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(Y-),即10-5mol·L-1+
×0.1000 mol·L-1,据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(Y-),即10-5mol·L-1+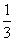 ×0.1000 mol·L-1=10-9mol·L-1+c(Y-),则有c(Y-)≈
×0.1000 mol·L-1=10-9mol·L-1+c(Y-),则有c(Y-)≈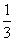 ×0.1000 mol·L-1,c(HY)=
×0.1000 mol·L-1,c(HY)=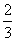 ×0.1000 mol·L-1-
×0.1000 mol·L-1-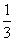 ×0.1000 mol·L-1=
×0.1000 mol·L-1=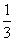 ×0.1000 mol·L-1,那么Ka(HY)=[c(Y-)·c(H+)]/c(HY)=(
×0.1000 mol·L-1,那么Ka(HY)=[c(Y-)·c(H+)]/c(HY)=(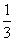 ×0.1000 mol·L-1×10-5mol·L-1)/(
×0.1000 mol·L-1×10-5mol·L-1)/(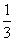 ×0.1000 mol·L-1)=10-5,B项正确。HX的酸性比HY的弱,滴定至HX恰好完全反应时,HY也完全反应,此时溶液中的溶质为NaX和NaY,X-的水解程度比Y-的水解程度大,则有c(Y-)>c(X-),C项错。HY和HZ混合,达到平衡时,据电荷守恒有c(H+)=c(Y-)+c(Z-)+c(OH-);对于弱酸HY来说,Ka(HY)=[c(H+)·c(Y-)]/c(HY),则有c(Y-)=[Ka(HY)·c(HY)]/c(H+),故c(H+)=[Ka(HY)·c(HY)]/c(H+)+c(Z-)+c(OH-),D项错。
×0.1000 mol·L-1)=10-5,B项正确。HX的酸性比HY的弱,滴定至HX恰好完全反应时,HY也完全反应,此时溶液中的溶质为NaX和NaY,X-的水解程度比Y-的水解程度大,则有c(Y-)>c(X-),C项错。HY和HZ混合,达到平衡时,据电荷守恒有c(H+)=c(Y-)+c(Z-)+c(OH-);对于弱酸HY来说,Ka(HY)=[c(H+)·c(Y-)]/c(HY),则有c(Y-)=[Ka(HY)·c(HY)]/c(H+),故c(H+)=[Ka(HY)·c(HY)]/c(H+)+c(Z-)+c(OH-),D项错。
答案:B
点拨:知识:酸碱中和滴定,酸性强弱与溶液导电能力的关系,弱酸电离平衡常数计算,溶液中离子浓度的比较。能力:考查考生的综合分析能力、逻辑推理能力和计算能力。试题难度:较大。




















