 资阳音乐生文化课集训学校哪里好
资阳音乐生文化课集训学校哪里好 【新学高考艺考生文化课补习班教学计划】
一、在短的时间内让学生摆脱因为高考失利造成的情绪低落。
二、总结经验教训,对过去的学习模式进行彻底突破。
三、不能松懈。不要因为距下次高考还有一段时间而出现松懈的学习状态。
四、注意方法,要苦学,勤学。
五、要重视课上听讲、记笔记。听讲是学习规律中的重要环节。
个性化课程设置和个性化课堂,我们构建了“高考文化课程+强化辅导课程+高考冲刺课程+心灵成长课程”,按照学学生的不同性格、学习兴趣的差异化和课堂的积极性,会特设个性化课堂,为学生的高考成绩和心灵成长保驾护航。
【新学高考管理模式】
新学高考高三冲刺营,吃住均在一个校区,让学生能更好的学习,老师定期与家长联系,让家长能及时的了解学生在学校里的情况,让家长无后顾之忧。
 资阳音乐生文化课集训学校哪里好
资阳音乐生文化课集训学校哪里好 新学高考是艺考生、复读生、应届生的不二之选。如果高三学生存在不同程度的知识弱项,可以来新学高考采取一对一或小班教学的复习方式,其他辅导学校大班式的教学,说实话对高考生复习帮助不大。
新学高考在收费上和其他学校相比起来略微有些贵,但是我只要孩子的成绩可以提升,另外再养成一个良好的学习习惯,就可以了。在这里读了一段时间,看到他身上的有进步的地方了,希望以后越来越好。
接待的老师特别亲切,还非常热情,带我们参观了校区,负一楼到五楼食堂教室寝室都参观了一遍,六楼因为是办公区所以就没去,总体来说很不错。
 资阳音乐生文化课集训学校哪里好
资阳音乐生文化课集训学校哪里好 1、关于1mol•1﹣1的Na2SO4溶液的叙述正确的是( )
A.溶液中含1molNa2SO4
B.Na+的浓度为1mol•1﹣1
C.配制时,将1molNa2SO4溶于1L水中
D.将322gNa2SO4•10H2O溶于少量水后再稀释成1000mL,即配制成相应溶液
【知识点】物质的量浓度
【答案】
考点:物质的量浓度.
分析:A、溶质离子数目与离子浓度、溶液体积有关.
B、由硫酸钠的化学式可知钠离子浓度为硫酸钠浓度的2倍.
C、将1molNa2SO4溶于水中配成1L溶液,硫酸钠的浓度为1mol/L.
D、322gNa2SO4的物质的量为1mol,溶液体积为1L,所配溶液的浓度为1mol/L.
解答: 解:A、1mol•L﹣1的Na2SO4溶液中钠离子的浓度为2mol/L,溶液体积未告诉,无法计算钠离子的物质的量,故A错误;
B、1mol•L﹣1的Na2SO4溶液中钠离子的浓度为2mol/L,故B错误;
C、将1molNa2SO4溶于水中配成1L溶液,硫酸钠的浓度为1mol/L,1L是溶液体积,不是溶剂的体积,故C错误;
D、332gNa2SO4的物质的量为1mol,溶液体积为1L,所配溶液的浓度为1mol/L,故D正确.
故选:D.
点评:本题考查学生对物质的量浓度的理解,难度不大,注意基础知识的理解掌握.
2、已知反应:2NO2 (g)⇌N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
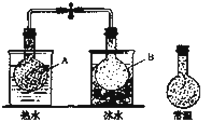
| | A. | 上述过程中,A烧瓶内正、逆反应速率均加快 |
| | B. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
| | C. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
| | D. | 反应2NO2(g)⇌N2O4(g)的逆反应为放热反应 |
【知识点】化学平衡
【答案】
考点:
化学平衡的影响因素. . | | 专题: | 化学平衡专题. |
| 分析: | A.升高温度,正、逆反应速率都增大; B.B烧瓶内气体颜色变浅,说明平衡向生成N2O4方向移动; C.容器的容积不变,混合气体的质量不变,结合ρ=判断. D.放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2,降低温度平衡向生成N2O4方向移动. |
| 解答: | 解:A.升高温度,正、逆反应速率都增大,故A正确; B.B烧瓶内气体颜色变浅,说明平衡向生成N2O4方向移动,B烧瓶内c(NO2)减小,c(N2O4)增大,故B正确; C.容器的容积不变,混合气体的质量不变,由ρ=可知,A烧瓶、B烧瓶内气体密度都不变,故C正确; D.放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2,降低温度平衡向生成N2O4方向移动,故反应2NO2(g)⇌N2O4(g)的正反应为放热反应,故D错误; 故选D. |
| 点评: | 本题考查化学平衡的影响因素,难度不大,根据不同温度下颜色变化判断平衡移动方向是关键. |
3、甲、乙两种非金属:①甲比乙容易与氢气化合;②甲能与乙的阴离子发生置换反应;③甲的高价氧化物对应的水化物酸性比乙的高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是( )
A.只有④ B.只有⑤
C.①②③ D.①②③④⑤
【知识点】物质结构 元素周期律单元测试
【答案】
C
【解析】④得电子数目的多少不能判断非金属性强弱,得电子的难易则可以;⑤熔、沸点不能作为判断非金属性强弱的依据。












