 凉山音乐生文化课冲刺机构推荐
凉山音乐生文化课冲刺机构推荐 新学高考艺考生文化课补习班教学计划
新学高考艺考生文化课补习班教学计划四步走
第一步、根据学生学生选择的班型,辅导方式制定适合学生的教学计划
第二步、根据学生入学测试的成绩找出学生薄弱点,根据薄弱点进行知识巩固理解
第三部、学生知识点掌握之后,进行知识点检测,找出学生难以突破的重点难点,讲解例题,帮助学生理解解题思路
第四部、高考模拟测试,稳定学生心态,让学生轻松应对高考
【新学高考管理模式】
每班配备两名专职班主任,关注和管理每班师生的上课情况与安全,每天点名、签到,如出现迟到、旷课情况及时和家长电话沟通,并反馈学生听课学习情况,如家长发现不负责任的班主任,请及时联系学校办公室并及时处理,直到家长和学生满意。
 凉山音乐生文化课冲刺机构推荐
凉山音乐生文化课冲刺机构推荐 我也是抱着试一试的心态,结果上了这次体验课,感觉真的很不错,孩子能听的进去也能消化重点,老师上课讲的几个知识点都很仔细,也很容易听懂,对孩子课后的反馈都是很认真很负责的
这是个专业培训高考文化课的学校,逛了一圈下来确实没有中小学生,比较专业,老师上课也很有针对性,抓住学生学习的薄弱处,孩子上完课也收获满满。
老师很负责,孩子进来上了试听课,不仅把孩子的问题找到了,而且给了具体问题的讲解答疑,还对后面的计划做了计划。我们家孩子反馈说不错。老师很负麦很有逻辑性,也很温柔。学校环境比较好,学习氛围很浓厚,在这里学习挺好的,打算一直让孩子在这里上课了。
 凉山音乐生文化课冲刺机构推荐
凉山音乐生文化课冲刺机构推荐 1、 下列有机反应类型判断错误的是:
A. ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应
B.  加成反应
加成反应
C. HOCH2CH2CH2OH
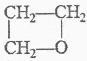 +H2O消去反应
+H2O消去反应
D. nCH2=O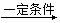
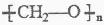 加聚反应
加聚反应
【知识点】烃的衍生物单元测试
【答案】
C
2、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )
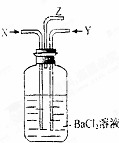
A. 洗气瓶中产生的沉淀是BaCO3
B. 在Z导管出来的气体中无CO2
C. 洗气瓶中产生的沉淀是BaSO3
D. 在Z导管口有红棕色气体出现
【知识点】非金属元素的单质及其化合物
【答案】
考点: 二氧化硫的化学性质.
分析: 据反应,判断X为SO2和CO2,Y为NO2,生成NO2和SO2发生反应生成硫酸和NO,故有硫酸钡生成,由于硝酸的存在,二氧化碳与氯化钡不能生成碳酸钡沉淀从溶液中逸出.
解答: 解:X为SO2和CO2,Y为NO2,XY混合之后SO2和NO2会发生氧化还原反应:SO2 +NO2+H2O=H2SO4+NO
A、因H2SO4能与氯化钡反应生成BaSO4,CO2与氯化钡不反应,没有BaCO3生成,故A错误;
B、因CO2不与氯化钡反应,从导管中逸出,故B错误;
C、因H2SO4能与氯化钡反应生成BaSO4,故C错误;
D、反应生成的NO在Z导管口与空气中的氧气反应生成NO2,呈红棕色,故D正确;
故选D.
点评: 本题主要考查了浓硫酸、浓硝酸的性质,根据物质的性质解释实验现象,培养了学生分析问题、解决问题的能力.
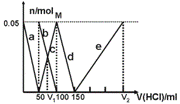
3、某Na2CO3、NaAlO2的混合溶液中逐滴
加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)
A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓
【知识点】金属元素的单质及其化合物
【答案】
【知识点】离子反应
【答案解析】B 解析:首先,发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-,
由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol.
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-,c线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol.得:M点时生成的CO2为0 mol;故A正确;原混合溶液中的CO32-与AlO-2的物质的量之比为0.05mol:0.05mol=1:1,故B错误;a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓,故D正确.
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+).
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,e线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体:0.15/1=0.15L=150mL.
原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应CO32-+H+═HCO3-可知,需要盐酸为0.025mol,盐酸的体积为0.025/1=0.025L=25mL,故V1=50mL+25mL=75mL,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故C正确;
故答案选B
【思路点拨】本题考查离子反应,关键是理清往Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸时,依次发生的反应。











 加成反应
加成反应 +H2O消去反应
+H2O消去反应









