 雅安艺考生集训文化课有哪些机构
雅安艺考生集训文化课有哪些机构 新学高考【学校优势】
新学高考一直以来以高考为目标,秉承以人为本。方法是死的,人是活的。新学高考区别于艺考生在学校时的常规复习步骤,在教学和复习上采用个性化和针对性化方式,研究实践表明这种方式大大提高了艺考生的学习效率。新学高考全日制教学,让学生的学习时间更合理。新学高考名师有多年高考培训经验,对新课标全国卷III、高考命题、高考研究、考试技巧、答题方法,授课有丰富的经验和独到之处,让艺考生不丢不该丢的分,稳固基础,在难题上拉开距离。后破茧成蝶。
【新学高考管理制度】
心理辅导:我们的老师会定期一对一与同学们进行沟通,让同学们树立信心,适当加压及增进动力,改进学习方法,制订目标;平时主题活动、体育活动、心理辅导保持备考阶段心态的平稳。
 雅安艺考生集训文化课有哪些机构
雅安艺考生集训文化课有哪些机构 孩子同学在新学上课,说学校有个物理刘老师还不错。就推荐我们去试听,娃儿很喜欢刘老师的课。说课堂幽默风趣,才上了半学期,第一次去学校转了几圈没找到。给学校打电话,咨询老师出来接我们的。接待老师很热情也很专业。
娃娃在新学高考学习了一个月了,老师每天都会在微信群里跟我们沟通娃娃的学习情况,月考下来分数提升了不少,特别是英语,现在都能及格了,希望娃娃继续努力考个好大学!
我本来是打算暑假给娃儿找个班课跟一跟的,那天到新学高考看看,老师带我去了解一下,我也是抱着多对比的心态去的,结果了解到了他们只做高三文化课,就抱着试一试的心态给娃儿申请了一次体验课,娃儿上了之后觉得比学校的老师讲得详细易懂一些,听了娃儿对老师的评价之后也有了很大感触,也就定了在新学高考继续学习。
 雅安艺考生集训文化课有哪些机构
雅安艺考生集训文化课有哪些机构 1、阿伏加德罗常数用NA表示,下列说法中正确的是( )
A.1 mol CH3+(碳正离子)中含有质子数为8NA
B.标准状况下,22.4 L溴单质所含原子数目为2NA
C.常温下,100mL lmol.L﹣l盐酸与4.6 g钠反应生成H2分子数目为0.1 NA
lmol.L﹣l盐酸与4.6 g钠反应生成H2分子数目为0.1 NA
D.密闭容器盛有0.1 mol N2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6 NA
【知识点】物质的量单元测试
【答案】
C
2、下列有关热化学方程式的叙述正确的是( )
| | A. | 已知2H2 (g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| | B. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol |
| | C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| | D. | 已知C (s)+O2(g)═CO2(g)△H1;C(s)+1/2 O2(g)═CO(g)△H2,则△H1>△H2 |
【知识点】化学反应中的能量变化
【答案】
考点:
热化学方程式.. | | 专题: | 化学反应中的能量变化. |
| 分析: | A、从燃烧热的定义来判断,燃烧热必须是生成稳定的氧化物. B、从中和热的定义来判断,中和热的热化学方程式必须让生成的水为1mol. C、从反应的吸放热角度能判断出石墨和金刚石的能量的高低,从而比较出稳定性. D、比较反应热的大小时要带着正负号比较. |
| 解答: | A、燃烧热指的是在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.定义要点:物质必须是完全燃烧生成稳定的氧化物,即反应物中C→CO2,H2→H2O(l),S→SO2(g).故241.8kJ/mol不是氢气的燃烧热.故A错误. B、在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热中和热.20.0gNaOH的物质的量n=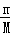 = =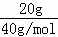 =0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量28.7kJ,故当生成1mol水时放热57.4KJ,故该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol,B正确. =0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量28.7kJ,故当生成1mol水时放热57.4KJ,故该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol,B正确. C、由C(石墨,s)═C(金刚石,s)△H>0,可知反应吸热,即石墨的能量低于金刚石,而能量越低物质越稳定,故石墨比金刚石稳定,故C错误. D、反应 C(s)+O2(g)═CO2(g)△H1 ①和反应 C(s)+1/2 O2(g)═CO(g)△H2 ②均为放热反应,△H均小于0. 由于反应①是碳的完全燃烧,②是碳的不完全燃烧,故①放出的热量多于②,则△H1<△H2.故D说法正确. 故选B. |
| 点评: | 本题考查了燃烧热的概念、中和热的计算以及反应热的大小比较,较简单. |
3、某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+m Y(g)  3 Z(g)平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3 Z(g)平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
【知识点】化学平衡单元测试
【答案】
D [A项,由题意可知两种条件下X、Y、Z的初始物质的量不同,而终平衡状态相同,则两种条件下建立的平衡为温度、容积不变时的等效平衡,故满足反应前后气态物质计量数之和相等,则1+m=3,m=2,正确;B项,温度不变,平衡常数不变,正确;C项,X、Y 的初始物质的量之比为1∶2,根据方程式可知参加反应的X、Y的物质的量之比也为1∶2,故X与Y的平衡转化率之比为1∶1,正确;D项,由方程式可知该反应反应前后气体的物质的量不变,所以第二次平衡时气体的总物质的量为4 mol,则Z的物质的量为4 mol×10%=0.4 mol,Z的浓度为0.4 mol÷2 L=0.2 mol·L-1,错误。]











