 成都市艺体生培训文化课有哪些机构
成都市艺体生培训文化课有哪些机构 新学高考艺考生优势
一、根据学生实际情况,找到提高学习成绩的快速通道,有针对性地为每个学生量身定制个性化教学辅导方案。
二、小班授课方式,提供随时答疑、陪读弥补了学生消化不良的情况,同时对学生进行有针对性的心理调节和心理辅导,降低学生的心理压力和焦虑水平。
三、全日制学习模式,干净明亮的宿舍环境和卫生健康的食堂条件,全程班主任服务
【新学高考师资介绍】
1、新学高考拥有高素质的专职教师队伍
2、教学老师都具备丰富的高考教学经验和高超的课堂驾驭能力
3、学校除了严把教师应聘关,更加注重教师的日常教学管理
 成都市艺体生培训文化课有哪些机构
成都市艺体生培训文化课有哪些机构 体验了一下英语课感觉不错哦,英语老师特别认真负责,讲了很多,学到了很多学校学不到的东西,收获很多,感觉我这个学渣有希望了
在网上看的学校宣传,于是就和家里人一起过来看了,现在已经在这里学习2个月了,一切都很好,也没有什么不适应的,同学和老师都很不错的,学习环境我也很喜欢。
但能感受到谢老师的专业素养,教学水平得到了孩子的高度评价。化学一直娃娃的弱项,希望在新学孩子的化学能有所提升,对化学这个科目的态度也能有更好的房认知。疫情影响李孩子的学习,效果好的话,我们再多报几科!
 成都市艺体生培训文化课有哪些机构
成都市艺体生培训文化课有哪些机构 1、25 ℃时某些弱酸的电离平衡常数如下表所示:
| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
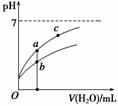 常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中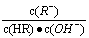 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
【知识点】电离平衡单元测试
【答案】
B
2、化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
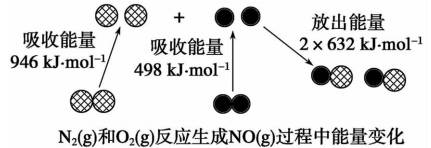
下列说法正确的是
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一.种酸性氧化物,能与NaOH溶液反应生成盐和水
【知识点】化学反应中的能量变化
【答案】
B
3、在298K1.0l×l05Pa下,将32gSO2通入750mL 1mol/L KOH溶液中充分反应.测得反应放出xkJ的热量.已知在该条件下,lmolSO2通入1L 2mol/L KOH溶液中充分反应放出ykJ的热量.则SO2与KOH溶液反应生成KHSO3的热化学方程式正确的是
A.SO2+KOH═KHSO3△H=﹣kJ/mol
B.SO2+KOH═KHSO3△H=﹣kJ/mol
C.SO2+KOH═KHSO3△H=﹣kJ/mol
D.2SO2+2KOH═2KHSO3△H=﹣kJ/mol
【知识点】燃烧热和中和热
【答案】
【考点】有关反应热的计算.中学版权所有
【专题】燃烧热的计算.
【分析】在298K、1.01×105Pa下,将32g SO2通入750mL 1mol/L KOH溶液中充分反应,测得反应放出x kJ的热量,则2molSO2与3molKOH发生反应的热化学方程式为2SO2+3KOH=KHSO3+K2SO3+H2O,△H=4xkJ/mol,1mol SO2通入1L 2mol/L KOH溶液中充分反应放出y kJ的热量,则1molSO2与2molKOH发生反应的热化学方程式为SO2+2KOH=K2SO3+H2O,△H=ykJ/mol,根据盖斯定律答题.
【解答】解:在298K、1.01×105Pa下,将32g SO2通入750mL 1mol/L KOH溶液中充分反应,测得反应放出x kJ的热量,则2molSO2与3molKOH发生反应的热化学方程式为①2SO2+3KOH=KHSO3+K2SO3+H2O,△H=﹣4xkJ/mol,1mol SO2通入1L 2mol/L KOH溶液中充分反应放出y kJ的热量,则1molSO2与2molKOH发生反应的热化学方程式为②SO2+2KOH=K2SO3+H2O,△H=﹣ykJ/mol,根据盖斯定律将①﹣②得SO2与KOH溶液反应生成KHSO3的热化学方程式为SO2+KOH=KHSO3,△H=﹣kJ/mol,即SO2+KOH=KHSO3,△H=﹣kJ/mol;
故选A.
【点评】本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.











 常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是








