
铜仁高三文化课补习中心有哪些?
1、 新学教育致力于做教育界的星巴克,不仅有专业的师资,更有优质的后期服务团队。来这里上课的每个学生,都享受独立的1V1学习小教室,陪读教室里,给有专业的老师,随时可以帮助学员答疑解惑。目前18名教师,全部持有教资证,且有3人具备研究生学历,其他老师或毕业于985高校、或211高校、或师范类院校。新学的老师以恒心、责任心、创新、爱心、童心五心师德帮助每一位同学做好成绩的提升,力争做有温度的教育。
2、 环境挺好的,挺喜欢在这学习的,很有那个氛围,老师讲的课也比较容易就懂了,讲课的方式很幽默,也很有趣,大家相处的也都很好,个人感觉价格确实不贵,选对老师很重要,这里真的是一个不错的选择
3、 环境好,硬件设施齐全,老师认真负责,关键是氛围很好,老师围绕孩子解决孩子的各种问题,不仅是学习上,还有些娃娃不愿意沟通的。一切都为了孩子这点让人觉得很暖心。孩子也是各种喜欢这里的老师。
 铜仁高三文化课补习中心有哪些
铜仁高三文化课补习中心有哪些 新学高考艺考生课程简介:
新学高考为了使艺考生,有更好的学校效果和更理想的提高分数。设立了精品艺考生文化课补习班,精品艺考生文化课补习班的老师采用一种班型,一套教学方案和讲义的模式,帮助所有艺考生摆脱学习的问题和障碍。
新学高考管理模式
全日制封闭式管理,学生吃住都是在学校提供的场所
班主任全天管理,如需外出离校必须向班主任请假
定期举行高考模拟测试
早晚课程皆按照高中课表时间安排
 铜仁高三文化课补习中心有哪些
铜仁高三文化课补习中心有哪些习题
1、1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要20﹣50Mpa的高压和500℃的高温下,用铁作催化剂,且氨的产率为10%﹣15%.2005年美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2C12的铁化合物作催化剂,在常温常压下合成 出氨,反应可表示为N2+3H2=2NH3,下列有关说法正确的是( )
出氨,反应可表示为N2+3H2=2NH3,下列有关说法正确的是( )
A.不同的催化剂对化学反应速率的影响均相同
B.哈伯法合成氨是吸热反应,新法合成氨是放热反应
C.新法合成能在常温下进行是因为不需要锻炼化学键
D.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展愿景
【知识点】化学平衡单元测试
【答案】
【考点】合成氨条件的选择.
【专题】化学平衡专题.
【分析】A.不同的催化剂催化机理不同,效果也不同;
B.两个化学反应都是放热反应;
C.化学反应的实质是旧化学键的断裂和新化学键的形成;
D.高温条件需要大量能源;
【解答】解:A.不同的催化剂催化机理不同,效果也不同,但在其他条件相同时,转化率是一样的,故A错误;
B.新法合成与哈伯法合成都 是反应物总能量大于生成物总能量,所以都是放热反应,只是新法降低了反应所需的能量,减少能源消耗,故B错误;
是反应物总能量大于生成物总能量,所以都是放热反应,只是新法降低了反应所需的能量,减少能源消耗,故B错误;
C.新法实际上是降低了反应所需的能量,旧化学键要断裂、新化学键也同时生成,反应的本质与催化剂无关,故C错误;
D.高温条件需要大量能源,用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,减少能源消耗,所以新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景,故D正确;
故选D.
【点评】本题考查催化剂对化学反应的影响,催化剂能通过改变活化能而影响反应速率,但不影响平衡移动,为易错题.
2、维生素C的结构简式为:
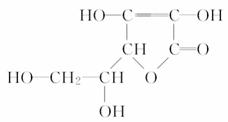 ,丁香油酚的结构简式为
,丁香油酚的结构简式为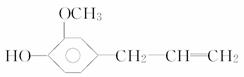 ,下列关于两者所含官能团的说法正确的是
,下列关于两者所含官能团的说法正确的是
( )
A.均含酯基 B.均含醇羟基和酚羟基
C.均含碳碳双键 D.均为芳香化合物
【知识点】烃单元测试
【答案】
解析 维生素C中含有的官能团为:碳碳双键、(醇)羟基、酯基,无苯环而不是芳香化合物。丁香油酚含有的官能团为:碳碳双键、醚键、(酚)羟基,是芳香化合物。
答案 C
3、已知 Na2SO3和 KIO3 反应过程和机理较复杂,一般认为分以下①~④步反应。
①IO3-+SO32-=IO2-+SO42-(反应速率慢)
②IO2-+2SO32-=I-+2SO42-(反应速率快)
③5I-+IO3-+6H+=3I2+3H2O(反应速率快)
④I2+SO32-+H2O=2I-+SO42-+2H+(反应速率快)
下列说法不正确的是:
A. IO2-和 I-是该反应的催化剂
B. 此反应总反应速率由反应①决定
C. 此反应①中氧化剂是IO3-,反应③中还原剂是 I-
D. 若生成 0.5mol 碘单质,则总反应中有 5mol 电子转移
【知识点】氧化还原反应
【答案】
【答案】A
【解析】
【分析】
此反应的4个步骤中,②③④为快反应,是瞬间完成的,而①为慢反应,直接决定了反应进行的快慢;
Na2SO3中S元素由+4价上升到+6价,KIO3中I元素由+5价降低到0价,由化合价守恒(电子守恒)配平方程式如下:5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O,
其中氧化剂是KIO3,反应中有10 mol电子转移,则生成的碘1 mol,以此分析。
【详解】A. 从4个步骤的反应可知,IO2-和 I-是反应的中间产物,不是反应的催化剂,故A错误;
B. 此反应的4个步骤中,②③④为快反应,是瞬间完成的,而①为慢反应,所以总反应速率由反应①决定,故B正确;
C. 反应①中IO3-→IO2-,化合价降低,被还原,IO3-作氧化剂;反应③中I-→I2,化合价升高,被氧化,I-作还原剂,故C正确;
D. 由总反应5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O可知,反应中有10 mol电子转移,则生成的碘1 mol,若生成 0.5mol 碘单质,有 5mol 电子转移,故D正确。
故选A。





 ,丁香油酚的结构简式为
,丁香油酚的结构简式为 ,下列关于两者所含官能团的说法正确的是
,下列关于两者所含官能团的说法正确的是





