 毕节高三文化课冲刺
毕节高三文化课冲刺 毕节高三文化课冲刺如何选学校?
1、新学高考的授课老师很优秀。新学高考选择老师时,首先要看授课老师是否拥有多年的带班经验,其次看授课老师是否对高考考纲有深入剖析,后是观察授课老师是否对每一个学生的学习情况和学习状态都了如指掌。
2、孩子在这儿上课进步还是非常大的,不仅仅是成绩提高了,还有一些学习习惯也变好了,之前都是我们催到他学习,现在回家都是自己就去房间看书做作业了,孩子能有今天还是要非常感谢新学高考!
3、个人感觉新学高考很不错,我在新学高考学习的5个月,学习成提升了不少,学校的老师讲课很用心,讲的课程内容很容易听懂,就算有的学生没听懂,课后老师都还会给学生在讲解,知道学生听懂了,才会讲解下一个重点.
 毕节高三文化课冲刺如何选学校
毕节高三文化课冲刺如何选学校 【开设班型】
新学高考只开设高三课程,包含班型有一对一和班课,详情请到校详细了解。
新学高考管理模式
封闭式集训,规范管理。解决家长的后顾之忧。
学习管理师全程跟踪反馈学生学习情况,进行有效沟通,实现家、校无缝对接
学生学习时间严格按照高中学校的时间安排,让学生能够感受到浓厚的学习环境
 毕节高三文化课冲刺如何选学校
毕节高三文化课冲刺如何选学校毕节高三文化课冲刺习题
1、下列状态中,可以证明可逆反应N2 + 3H2 2NH3已达平衡状态是
2NH3已达平衡状态是
①一个N≡N键断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其他条件不变时,体系压强不再改变
④ω(NH3)、ω(N2)和ω(H2)都不再改变
⑤恒温恒容时,密度保持不变
⑥υ正(H2)=0.03 mol·L-1·min-1,υ逆(NH3)=0.02 mol·L-1·min-1
A.全部 B.②③④⑥ C.③④⑤⑥ D.②③④⑤⑥
【知识点】化学键
【答案】
【答案】B
【解析】①一个N≡N断裂的同时,有3个H-H键断裂,表示的都是正反应速率,无法判断正逆反应速率是否相等,故①错误;②一个N≡N键断裂的同时,有6个N-H键断裂,正逆反应速率相等,达到了平衡状态,故②正确;③保持其它条件不变时,体系压强不再改变,反应方程式两边气体的体积不相等,压强不变,说明正逆反应速率相等,达到了平衡状态,故③正确;④NH3、N2、H2的体积分数都不再改变,说明各组分的浓度不变,达到了平衡状态,故④正确;⑤恒温恒容时,混合气体的密度保持不变,由于气体的质量不变,容器的容积不变,所以气体的密度始终不变,故密度无法判断是否达到平衡状态,故⑤错误;⑥正反应速率v(H2)=0.6mol/(L•min),逆反应速率v(NH3)=0.4mol/(L•min),说明正逆反应速率相等,达到了平衡状态,故⑥正确;故选B。
电极:本题考查化学平衡状态的判断。注意方程式中气体的化学计量数关系,注意平衡时的浓度关系、物质的量关系不能作为判断是否平衡的依据。
2、下列说法正确的是
A.常温下0.4 mol/L HB溶液 和0. 2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
【知识点】电离平衡 水解平衡
【答案】
B
3、对于可逆反应N2(g)+3H2(g)  2NH3(g) △H<0,下列研究目的和图示相符的是
2NH3(g) △H<0,下列研究目的和图示相符的是
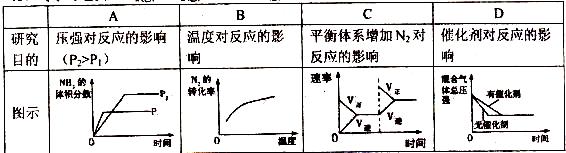
【知识点】化学反应速率
【答案】
【答案】C
【解析】
试题分析:A、该反应正向为气体物质的量减小的反应,增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,错误;B、因该反应是放热反应,升高温度,化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,错误;C、反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,正确;D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,错误。
考点:考查化学平衡图像分析




















