
仁怀艺考生文化课冲刺中心前三?
1、给孩子找复读学校,在网上看到很多人推荐新学高考,就去了解了一下,校区很干净整洁,教室、宿舍、食堂和办公区域布局也很合理,总的来说很不错!
2、 在这里想跟众多家长说,小班的教学效果同样是有效的,关键是找到适合孩子方法的。孩子同样在新学高考学习,小班的效果更明显!
3、朋友推荐的,来听了一节试听课,教室挨得挺近的,但是隔音效果很好,一个班大概十多个人,老师非常nice,讲课很有趣,上课氛围超级好。
 仁怀艺考生文化课冲刺中心前三
仁怀艺考生文化课冲刺中心前三 【开设班型】
高考冲刺班:1V1 班课艺考文化课补习班:1V1 班课高考复读:1V1 班课
新学高考管理模式
学习管理师全程监督指导,及时反馈随时修订辅导方案,保证效果。
新学高考冲刺营,吃住均在一个校区,让学生能更好的学习,老师定期与家长联系行内资深人士亲自指导我们的学生选择大学,和志愿的填报,降低因志愿填报不当而落榜的概率。
 仁怀艺考生文化课冲刺中心前三
仁怀艺考生文化课冲刺中心前三习题
1、已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:Ka1=1.3×10-7,Ka2=7.1×10-15。常温下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法不正确的是( )。
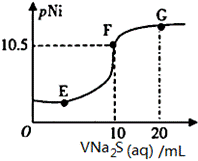
A. E、F、G三点中,F点对应溶液中水电离程度小
B. 常温下,Ksp(NiS)=1×10-21
C. 在NiS和NiCO3的浊液中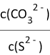 =1.4×1014
=1.4×1014
D. Na2S溶液中,S2-第一步水解常数Kh1=
【知识点】电离平衡 水解平衡
【答案】
【答案】D
【解析】
分析:硝酸镍是强酸弱碱盐,硫化钠是强碱弱酸盐,它们都能促进水的电离。F点表示硝酸镍和硫化钠恰好完全反应,溶液中溶质是硝酸钠,据此分析A的正误;根据NiS(s)  Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)分析B的正误;根据NiCO3(s)+S2-(aq)
Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)分析B的正误;根据NiCO3(s)+S2-(aq)  NiS(s)+CO32-(aq) K=
NiS(s)+CO32-(aq) K= 分析C的正误;根据S2-+H2O
分析C的正误;根据S2-+H2O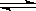 HS-+OH-,Kh1=
HS-+OH-,Kh1=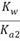 分析D的正误。
分析D的正误。
详解:A.硝酸镍是强酸弱碱盐,硫化钠是强碱弱酸盐,它们都能促进水的电离。F点表示硝酸镍和硫化钠恰好完全反应,溶液中溶质是硝酸钠,水的电离程度小,故A正确;B.NiS(s) 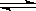 Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)=1×10-21,故B正确;C.NiCO3(s)+S2-(aq)
Ni2+(aq)+S2-(aq),Ksp(NiS)=c(Ni2+)c(S2-)=1×10-21,故B正确;C.NiCO3(s)+S2-(aq) 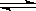 NiS(s)+CO32-(aq) K=
NiS(s)+CO32-(aq) K= =
=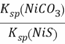 =1.4×1014,故C正确;D.S2-+H2O
=1.4×1014,故C正确;D.S2-+H2O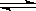 HS-+OH-,Kh1=
HS-+OH-,Kh1=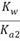 =
=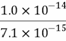 ,故D错误;故选D。
,故D错误;故选D。
点睛:本题考查了电解质溶液中的平衡表达式的计算,掌握和理解平衡表达式是解题的关键。本题的易错点为A,要注意能够水解的盐促进水的电离,酸或碱抑制水的电离。
2、下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的是( )
| | A | B | C | D |
| X | FeCl3溶液 | FeCl3溶液 | Cu | Na2SO4溶液 |
| Y | FeCl2 | CuCl2 | Fe | Na2CO3 |
| Z | Fe | Fe | 稀硫酸 | BaCl2溶液 |
【知识点】金属元素的单质及其化合物
【答案】
选C。A项,2FeCl3+Fe====3FeCl2,主体成分FeCl3被消耗了;B项,2FeCl3+Fe====3FeCl2,CuCl2+Fe====FeCl2+Cu,主体成分FeCl3被消耗了;C项,Fe+H2SO4====FeSO4+H2↑,而Cu不与稀硫酸反应;D项,Na2SO4、Na2CO3均与BaCl2反应:Na2SO4+BaCl2====BaSO4↓+2NaCl,Na2CO3+BaCl2====BaCO3↓+2NaCl,主体成分Na2SO4被消耗了。
3、下列各组热化学方程式中,化学反应的△H前者 大于后者的是()
大于后者的是()
①C(s)+O2(g)═CO2(g);△H1 C(s)+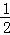 O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+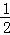 O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
A. ① B. ④ C. ②③④ D. ①②③
【知识点】燃烧热和中和热
【答案】
考点: 反应热的大小比较.
专题: 化学反应中的能量变化.
分析: ①②③为放热反应,物质发生化学反应时,生成液态水比生成气态水放出的热量多,反应越完全,放出的热量越多,
④中前者为吸热反应,后者为放热反应,吸热反应△H>0,放热反应△H<0,以此解答该题.
解答: 解:①都为放热反应,△H<0,前者完全反应,放出的热量多,则△H1<△H2,故①错误;
②都为放热反应,△H<0,由于S(s)→S(g)吸热,则前者放出的热量少,则△H3>△H4,故②正确;
③都为放热反应,△H<0,消耗的氢气越多,则放出的热量越多,则△H5>△H6,故③正确;
④前者为吸热反应,△H7>0,后者为放热反应,△H8<0,则△H7>△H8,故④正确.
故选C.
点评: 本题考查反应热的大小比较,题目难度中等,本题注意从物质反应的程度以及物质的聚集状态的角度比较反应热的大小,本题中含有能正确判断反应的吸放热.












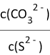 =1.4×1014
=1.4×1014








