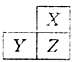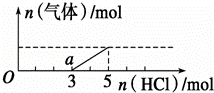贵阳传媒生文化课补习机构大概收费?
1、我们看了这么多家机构下来决定还是在新学高考报的名,老师很负责任,主要是孩子喜欢,愿意在这里上课,合适自己的孩子重要,不然孩子不喜欢再怎么补课也是白搞。
2、孩子今年就要高考了,之前去学音乐大半年都没碰文化课了,就怕文化过不了关,在新学高考老师的建议下报了一对一。幸好近几次周考总分有提高,希望孩子能够好好学习,考个好大学!
3、 来了这里,接待的老师很亲切。仔细询问学生的情况。然后又一一介绍了班级,感觉挺温馨的。上课的老师感觉很风趣幽默,讲知识也很全面,我基础不是特别好,但是上课几乎都能听懂。准备介绍给我朋友,带着他们一起来!
 贵阳传媒生文化课补习机构大概收费
贵阳传媒生文化课补习机构大概收费 【开设班型】
个性化专属一对一辅导(量身定制学习方案,老师全程一对一针对训练,提分有保障)9-18人班课(适合基础较好的同学,性价比高)
 贵阳传媒生文化课补习机构大概收费
贵阳传媒生文化课补习机构大概收费习题
1、X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的外层电子数是其次外层电子数的3倍,下列说法正确的是( )
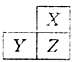
A. 原子半径:Y>Z>X
B. 气态氢化物的热稳定性:X<Z
C. y和z的高价氧化物对应水化物均为强酸
D. 若z的高正价为+m,则X的高正价也一定为+m
【知识点】物质结构 元素周期律单元测试
【答案】
【答案】A
【解析】由题意可知,X元素为O元素,Z元素为S元素,Y元素为P元素。同周期元素从左到右半径减小,同主族元素从上到下半径增大,A正确;氢化物的稳定性强弱是比较非金属性强弱,由于O元素的非金属性比硫S强,所以B错;P的高价氧化物对应的水化物为H3PO4为中强酸,S元素的高价氧化物对应的水化物为H2SO4为强酸C错;S的高价为+6价,而O无正价D错。
2、将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
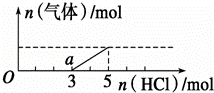
A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.常温下,a点溶液pH>7
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5mol/L
【知识点】离子反应
【答案】
【考点】离子方程式的有关计算.
【分析】A、Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故溶液中溶质为NaOH、Na2CO3;
B、a点溶液中溶质为碳酸氢钠;
C、由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积大时,该阶段消耗的HCl的物质的量为2mol,据此根据方程式计算生成的二氧化碳的物质的量,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,根据V=nVm计算二氧化碳的体积;
D、生成二氧化碳体积大时,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl),再根据钠离子守恒有n(NaOH)=n(NaCl),根据c=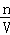 计算NaOH溶液的物质的量浓度.
计算NaOH溶液的物质的量浓度.
【解答】解:A、Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,HCl与Na2CO3、NaHCO3都按1:1反应,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故溶液中溶质为NaOH、Na2CO3,故A正确;
B、a点溶液中溶质为碳酸氢钠,碳酸氢钠溶液显碱性,则溶液pH>7,故B正确;
C、由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积大时,该阶段消耗的HCl的物质的量为2mol,由方程式可知产生二氧化碳的物质的量为2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,故开始通入的二氧化碳的体积为2mol×22.4L/mol=44.8L,故C错误;
D、加入5molHCl生成二氧化碳体积大,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl),根据钠离子守恒有n(NaOH)=n(NaCl),故n(NaOH)=n(HCl)=5mL,所以c(NaOH)=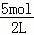 =2.5mol/L,故D正确;
=2.5mol/L,故D正确;
故选C.
【点评】本题考查混合物的计算,题目难度中等,注意从图象分析反应发生的情况,关键是根据图象判断溶液溶质的成分.
3、如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )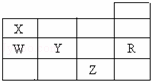
A. 常压下五种元素的单质中,Z单质的沸点高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物的稳定性比X的氢化物的稳定性高
D. Y元素的非金属性比W元素的非金属性强
【知识点】物质结构 元素周期律单元测试
【答案】
考点: 元素周期律和元素周期表的综合应用.
分析: 由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.根据物质的在常压下的存在形式分析,常压下S、P为固体,而Br为液体;
B.Y的阴离子核外有18个电子,Z的阴离子核外有36个电子,以此进行分析;
C.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
D.同周期从左到右元素的非金属性逐渐增强.
解答: 解:由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.常温下氮气、氩为气体,磷、硫为固体,而溴为液,故溴的沸点不是高的,故A错误;
B.Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误;
C.同主族自上而下非金属性减弱,非金属性X>W,非金属性越强,氢化物越稳定,故氢化物稳定性X>W,故C错误;
D.同周期从左到右元素的非金属性逐渐增强,故金属性非金属性Y>W,故D正确,
故选D.
点评: 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握.