
仁怀艺考生文化课集训学校前五?
1、我目前就是在新学高考补习的一名学生,文科生,我现在的班级上人不是很多,我们科任老师讲课的方式和之前学校的老师讲的不一样,总之就是很容易就搞懂了,现在学习的很顺心啊。
2、 孩子体验完课程之后效果非常明显,孩子给我反馈老师上课很幽默,一对一的效率很高,一样的时间可以学更多知识,以后孩子的补课就安排在这里了,很让人放心。
3、 马上面临高考,学习非常紧张,新学高考的一对一课程真的非常有效,平时老师对于孩子课下的一些问题也能够解答,新学高考的这个校区离我家近,上课也非常方便,期待孩子高考考出好成绩!
 仁怀艺考生文化课集训学校前五
仁怀艺考生文化课集训学校前五 【开设班型】
个性化专属一对一辅导(量身定制学习方案,老师全程一对一针对训练,提分有保障)9-18人班课(适合基础较好的同学,性价比高)
【新学高考师资介绍】
新学高考的教师团队,是一群资深的热爱教育事业的精英教育人士,我们的教学老师都是有着许多年高三授课教学经验的,授课风格严肃且活泼,学生在轻松的环境中掌握知识点。作为老师我们认真对待学生之间的差异,使用因材施教的教育法则,在教学过程中力求每位学生都能听懂。牢记社会赋予我们的使命和责任,尊重学生的个性。让每一个学生热爱学习,学会学习。
 仁怀艺考生文化课集训学校前五
仁怀艺考生文化课集训学校前五习题
1、用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA
B.常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA
C.常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH﹣,0.02NA
D.1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA
【知识点】物质的量单元测试
【答案】
【考点】阿伏加德罗常数.
【分析】A.Cl2为氧化性较强的非金属单质,和变价金属反应生成高价态的金属氯化物,铁与氯气反应生成氯化铁,但1molCl2与足量的铁反应,氯气量不足,电子转移依据氯气计算分析;
B.CO2和N2O的摩尔质量都是44g/mol,二者分子中都含有22个电子;
C.氢氧根离子数目可以以计算物质的量得到;
D.水中也含有氢原子.
【解答】解:A.氯气单质是强氧化剂,能将变价金属氧化到高价态,铁与氯气反应,2Fe+3Cl2
 2FeCl3,铁从0价变为+3价,1mol铁失去3mol电子,电子数为N=n×NA=3×NA=3NA,但需1.5mol氯气,1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA,故A错误;
2FeCl3,铁从0价变为+3价,1mol铁失去3mol电子,电子数为N=n×NA=3×NA=3NA,但需1.5mol氯气,1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA,故A错误;
B.CO2和N2O的摩尔质量相同,都是44g/mol,则8.8gCO2和N2O的物质的量为: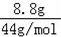
 =0.2mol,二者都含有22个电子,则0.2mol混合气体中含有的电子的物质的量为:22×0.2mol=4.4mol,混合气体中所含的电子数为4.4NA,故B正确;
=0.2mol,二者都含有22个电子,则0.2mol混合气体中含有的电子的物质的量为:22×0.2mol=4.4mol,混合气体中所含的电子数为4.4NA,故B正确;
C.0.10L pH=13的Ba(OH)2溶液中OH﹣的数目=0.1L×0.1mol/L×NA=0.01NA,故C错误;
D.1 L 1 mol/L的乙醇水溶液中含乙醇1mol,水中含有氢原子,含有的氢原子总数大于6NA,故D错误;
故选B.
2、在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中发生反应X(g)+ Y(g)2Z(g) ΔH < 0,一段时间后达到平衡。反应过程中测定的数据如下:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-5 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
【知识点】化学平衡单元测试
【答案】
答案 C
解析 反应前2 min的平均速率v(Y)=(0.16-0.12) mol÷10 L÷2 min=2.0×10-3 mol·L-1·min-1,v(Z)=2v(Y),v(Z)=4.0×10-3 mol·L-1·min-1,故A错误;正反应放热,降低温度平衡正向移动,反应达到新平衡前v(逆)<v(正),故B错误;
X(g)+Y(g)2Z(g)
开始/mol·L-1 0.016 0.016 0
转化/mol·L-1 0.006 0.006 0.012
平衡/mol·L-1 0.01 0.01 0.012
K=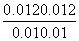 =1.44,故C正确;其他条件不变,再充入0.2 mol Z,相当于增大压强,平衡不移动, X的体积分数不变,故D错误。
=1.44,故C正确;其他条件不变,再充入0.2 mol Z,相当于增大压强,平衡不移动, X的体积分数不变,故D错误。
3、下列反应终能生成Fe3+的化合物的是()
①过量Fe与HNO3
②铁丝在硫蒸汽中燃烧
③向FeBr2溶液中通入Cl2
④铁与CuCl2溶液反应
⑤Fe(OH)2露置于空气中.
A. ①②③ B. ①③⑤ C. ③④ D. ③⑤
【知识点】铁和铁的化合物
【答案】
考点: 铁盐和亚铁盐的相互转变.
分析: ①Fe与HNO3反应生成硝酸铁,Fe3+与Fe反应生成Fe2+;
②铁丝在硫蒸汽中燃烧生成FeS;
③向FeBr2溶液中通入Cl2,Fe2+还原性大于Br﹣,氯气首先把Fe2+氧化为Fe3+;
④铁与CuCl2溶液反应生成氯化亚铁和铜;
⑤Fe(OH)2露置于空气中,与氧气、水反应生成氢氧化铁.
解答: 解:①Fe与HNO3反应生成硝酸铁,Fe3+与Fe反应生成Fe2+,故不选;
②铁丝在硫蒸汽中燃烧生成FeS,故不选;
③向FeBr2溶液中通入Cl2,Fe2+还原性大于Br﹣,氯气首先把Fe2+氧化为Fe3+,故选;
④铁与CuCl2溶液反应生成氯化亚铁和铜,故不选;
⑤Fe(OH)2露置于空气中,与氧气、水反应生成氢氧化铁,故选;
故选D.
点评: 本题考查了铁及其化合物的性质,难度不大,掌握元素及其化合物的性质是解题的关键,注意氧化剂氧化还原剂时的先后顺序.



















