
黔南高三文化课集训班哪里好?
1、 新学的老师很热情,我们刚到他们就亲切地询问孩子的情况,校区环境还是不错,干净整洁,感觉管理还是可以,也不晓得上课效果怎么样,还需要时间和结果来验证。
2、 成都本土著名的教育品牌,该校为成都市大的高考复读生精品基地,首家艺术专业课与文化课双签约教学权威机构,据说是大的艺考生文化集训基地,高档次全封闭全日制培训机构。
3、去年来是刘老师接待的我们,带我们参观了校区,关心的还是师资,通过试听娃娃反馈挺好的,说老师上课很有意思,也能学到东西。
 黔南高三文化课集训班哪里好
黔南高三文化课集训班哪里好 【开设班型】
新学高考有两种班型。一种是一对一班,还有一种是班课。初次分班后,新学高考的老师会结合学生知识接受的程度和学习能力进行适配调整
新学高考艺考生中心师资介绍
新学高考艺考生中心的师资自是不必多说,我们有资本说我们的老师都是行业内佼佼者,我们的老师都是具备丰厚的专业知识,从教年龄亦是不可小觑,我们有众多一线公立学校挖过来的的优秀教师,也有学校从各个名校招聘的专业教师,专注高考辅导,针对艺考生的短板更是自有一套方法。
 黔南高三文化课集训班哪里好
黔南高三文化课集训班哪里好习题
1、既可用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
A.混合气体通过盛水的洗气瓶
B.混合气体通过装有过量溴水的洗气瓶
C.混合气体和过量H2混合
D.混合气体通过酸性高锰酸钾溶液
【知识点】乙烯 烯烃
【答案】
B
2、按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是( )
A.FeB.MgC.BrD.Cu
【知识点】物质结构 元素周期律单元测试
【答案】
【考点】元素周期表的结构及其应用.
【分析】电子后填入的能级是p能级的元素属于P区元素,P区元素的外围电子排布为ns2npx,包含第ⅢA~ⅦA族及零族元素,电子后填入的能级是s能级的元素属于s区元素(注意氦元素除外),包括ⅠA、ⅡA族元素,电子后填入的能级是d能级的元素属于d区元素,包括ⅢB~ⅦB及Ⅷ族,ds区包括ⅠB族(11列)、ⅡB族(12列),可以理解为先填d能级后填s能级而得名,此外还有f区,包含镧系、锕系.
【解答】解:A、Fe的外围电子排布为3d64s2,属于d区元素,故A不符合;
B、Mg的外围电子排布为3s2,属于s区元素,故B不符合;
C、Br的外围电子排布为3s23p5,所以p区元素,故C符合;
D、Cu为ⅠB元素,属于ds区,故D不符合;
故选C.
3、将一定量的氯气通入300ml浓度为1mol/L的浓NaOH溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系.下列判断不正确的是( )
A.n(Na+):n(C1﹣)可能为7:3
B.n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2
C.参加反应氯气物质的量为0.15mol
D.反应中转移电子物质的量n的范围:0.15mol<n<0.25mol
【知识点】氧化还原反应
【答案】
【考点】氧化还原反应的计算.
【专题】氧化还原反应专题.
【分析】n(NaOH)=1mol/L×0.3L=0.3mol/L,氯气和氢氧化钠恰好反应生成NaCl、NaClO及NaClO3,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3),再根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),根据转移电子守恒得n(C1﹣)=n(ClO﹣)+5n(ClO3﹣),
A.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl﹣)大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl﹣)小为6:5;
B.令n(NaCl)=11mol,n(NaClO)=1mol,n(NaClO3)=2mol,根据电子转移守恒判断;
C.根据氯原子守恒2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)判断;
D.利用极限法解答,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数少,氧化产物只有NaClO3,转移电子数多.
【解答】解:A.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl﹣)大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl﹣)小为6:5,故6:5<n(Na+):n(Cl﹣)<2:1,7:3>2:1,故A错误;
B.令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为1mol×1+2mol×5=11mol,得失电子相等,故B正确;
C.氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故C正确;
D.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数少,为0.3mol× ×1=0.15mol,氧化产物只有NaClO3,转移电子数多,为0.3mol×
×1=0.15mol,氧化产物只有NaClO3,转移电子数多,为0.3mol×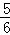 ×1=0.25mol,故D正确;
×1=0.25mol,故D正确;
故选A.
【点评】本题考查了氧化还原反应的有关计算,根据原子守恒及转移电子守恒是解本题关键,并结合极限法分析解答,难度中等.



















