
毕节美术生文化课冲刺中心列表?
1、 装修挺好看的,格局挺大的,上课的老师能看的出来是培训过得,不过专业度还是可以的,老师们都很厉害,老师很热心,反正地方我是比较喜欢,我就选择这家了
2、 教室多宽敞明亮,小班教学和一对一的都有挺不错的。孩子在这里学习补课还是让人放心,王老师教得有耐心有的题连续反复讲几遍直到大家都明白得【环境】环境各方面都还不错!【设施】都是高考标准的多媒体设备【课程】带小妹去体验了一节课,看到有很多学生在学习,走路的脚步声都不敢弄响了,感觉现在的学生们都有斗志,学习氛围也挺不错,关键是小妹能听得懂,喜欢刘老师的讲课方式。
3、 之前也去过其他机构,感觉效果一般,孩子也挺努力的,可就是成绩这块上不去,要高考啦也是挺愁的。后来接孩子放学的时候,有一位新学的老师跟我聊起来,她说她之前也遇到过很多这样的学生,方向不对,努力都白费了,如果不有糖找到一个好的适合自己的学习方法,感觉就好像是拿着破了的网去捕鱼,怎么能满载而归呢,是啊,谁说不是呢。就决定带孩子去看看,环境和教学设施都不错,当老师介绍到教室是冷暖灯光,更有助于孩子学习,保护视力的时候,我觉得虽是小细节,但能这样,相信师资这块肯定也不会差,果然后面的互动式教学,课堂气氛都很好,把孩子交到这里,放心
 毕节美术生文化课冲刺中心列表
毕节美术生文化课冲刺中心列表 【开设班型】
新学高考有两种班型。一种是一对一班,还有一种是班课。初次分班后,新学高考的老师会结合学生知识接受的程度和学习能力进行适配调整
【新学高考师资介绍】
上课老师均是一线名师,在知识体系梳理、学习方法讲解、解题技巧讲授,缓解学生的心理压力方面都具备极高的专业水平,使学生全身心应对考试,帮助想上名校的学子顺利考上理想大学。
 毕节美术生文化课冲刺中心列表
毕节美术生文化课冲刺中心列表习题
1、X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z外层电子数之和与W的外层电子数相同,25℃时,0.1mol/L X和W形成化合物的水溶液pH为1.下列说法正确的是( )
A.由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物
B.Y和其他四种元素均可形成至少两种的二元化合物
C.RY2能与Y、Z形成的一种化合物反应生成Y2
D.Y、Z、W三种元素组成化合物的水溶液一定显碱性
【知识点】物质结构 元素周期律单元测试
【答案】
【考点】元素周期律和元素周期表的综合应用.
【分析】X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2,则Y为氧元素,R为硫元素,RY2为SO2,W的原子序数大于硫元素,故W为Cl元素,Y和Z外层电子数之和与W的外层电子数相同,则Z的外层电子数为7﹣6=1,处于第ⅠA族,原子序数大于氧元素,故Z为Na元素,25℃时0.1mol•L﹣1X和W形成化合物的水溶液pH为1,属于强酸,则X为氢元素.
【解答】解:X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2,则Y为氧元素,R为硫元素,RY2为SO2,W的原子序数大于硫元素,故W为Cl元素,Y和Z外层电子数之和与W的外层电子数相同,则Z的外层电子数为7﹣6=1,处于第ⅠA族,原子序数大于氧元素,故Z为Na元素,25℃时0.1mol•L﹣1X和W形成化合物的水溶液pH为1,属于强酸,则X为氢元素,
A.X与Y组成化合物为H2O、H2O2,X与R组成的化合物H2S,H2O、H2O2分子间存在氢键,沸点高于硫化氢,与非金属性无关,故A错误;
B.氧元素与氢元素可以形成H2O、H2O2,与钠元素可以形成Na2O、Na2O2,与硫元素可以形成SO2、SO3,与氯元素可以形成ClO2、Cl2O7等,故B正确;
C.Z与Y可以形成Na2O、Na2O2,Na2O与SO2反应得到Na2SO3,Na2O2具有强氧化性,能与SO2反应生成Na2SO4,没有O2生成,故C错误;
D.Y、Z、W三种元素组成的化合物有NaClO、NaClO4等,NaClO溶液中次氯酸根水解,溶液显碱性,而NaClO4溶液呈中性,故D错误.
故选:B.
2、下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定
②HCl和H2S的水溶液前者的酸性强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
A.②⑤ B.①②
C.①②④ D.①③⑤
【知识点】物质结构 元素周期律单元测试
【答案】
【答案】A
【解析】①HCl比H2S稳定,说明氯原子比硫原子更易结合氢原子,即氯的非金属性比硫强,故①正确.
②元素的非金属与元素高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,即②不正确.
③HClO4和H2SO4分别是氯、硫两元素高价氧化物对应的水化物,HClO4酸性强,说明氯元素非金属性强,故③正确
④Cl2能与H2S反应生成S,即Cl2+H2S=S↓+2HCl,说明Cl2的氧化性比S的氧化性强,即Cl夺取电子的能力比S强,非金属性:Cl>S,故④正确.
⑤非金属性与形成稳定离子需要得几个电子无关,即⑤不正确.
⑥Cl2与Fe反应生成FeCl3,说明Cl能夺取Fe的3个电子;S与Fe反应生成FeS说明S只能夺取Fe的2个电子.因此非金属性Cl>S,即⑥正确.
综上分析,②⑤不能说明氯的非金属性比硫强,
故选A.
3、硫代硫酸钠可用作脱氯剂,已知25.0 mL 0.1 mol/L的Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-时,S2O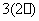 转化成( )
转化成( )
A.S2- B.S C.SO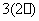 D.SO
D.SO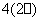
【知识点】氧化还原反应
【答案】
C











