
毕节好的美术生文化课辅导学校?
1、我们娃娃开始比较排斥学习,结果新学高考的班主任王老师找他单独聊天,也不晓得说了啥子,娃娃现在学习积极性也有了,有这么负责的老师,我们当家长的也可以少操心了。
2、孩子成绩差,建议大家找补习机构一定要了解清楚机构的教学模式,我妹妹之前就是匆匆忙忙找了一家,学了三个月成绩没什么变化,后来亲戚家的孩子说新学高考的教学特别好,学习也轻松,她之前就在哪里补习,后面也去学校了解了,他们的教学计划和管理模式都不错就报名了,去了一个多月,妹妹成绩就有进步了。
3、娃娃高一的时候就听说过新学高考很不错,但是他们只招高三的学生。现在娃娃高三了,成绩一直不稳定,我就带娃娃去新学高考看了一下,果然非常不错,老师上课也很幽默风趣,娃娃学习兴趣都提高了。
 毕节好的美术生文化课辅导学校
毕节好的美术生文化课辅导学校 【新学高考艺考生文化课补习班收费】
新学高考艺考生文化课补习班收费是根据学生选择的不同班型按课时收取费用的
【专业的师资管理团队】
整合了西南地区知名的教育专家、名校的金牌讲师,教育心理学硕士、高考艺考生补习专家、高考全日制班级金牌管理组、
 毕节好的美术生文化课辅导学校
毕节好的美术生文化课辅导学校习题
1、下列说法不正确的是()
A. 英国科学家道尔顿发现了元素周期律
B. 研究物质性质的基本方法有实验法、观察法、分类法、比较法
C. 化学的特征是认识分子和制造分子
D. 我国科学家合成的结晶牛胰岛素是世界上首次人工合成的具有生物活性的蛋白质
【知识点】碱金属单元测试
【答案】
考点: 化学史;化学研究基本方法及作用;分子等层次研究物质的意义.
分析: A、俄国化学家门捷列夫发现了元素周期律;
B、学习化学的基本方法有观察法、实验法、分类法、比较法等;
C、根据化学的研究范畴来分析;
D、我国首次人工合成具有生物活性的结晶牛胰岛素.
解答: 解:A、俄国化学家门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出第一张元素周期表,故A错误.
B、化学是一门以实验为基础的科学,化学反应中常常伴随一些特殊现象,所以学习化学的基本方法有观察法、实验法、分类法、比较法等,故B正确;
C、化学是研究物质的组成、性质、结构等的学科,其特征是认识分子和制造分子,故C正确;
D、我国首次人工合成具有生物活性的结晶牛胰岛素,故D正确.
故选A.
点评: 本题考查了常见的化学史,有利于激发学生学习化学的兴趣,难度不大.
2、在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)⇌CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是()
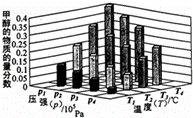
A. P3>P2 T3>T2 B. P2>P4 T4>T2
C. P1>P3 T3>T1 D. P1>P4 T2>T3
【知识点】化学平衡
【答案】
考点: 体积百分含量随温度、压强变化曲线.
分析: 根据平衡移动原理:增大压强,平衡向体积缩小的方向移动,温度升高,平衡向着吸热方向进行.在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)⇌CH3OH(g)+H2O(g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,结合图象判断甲醇的物质的量分数变化情况判断.
解答: 解:增大压强,平衡向体积缩小的方向移动,在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)⇌CH3OH(g)+H2O(g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,即P1>P2>P3>P4,
温度升高,平衡向着吸热方向进行,在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)⇌CH3OH(g)+H2O(g)△H<0,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,故T1>T2>T3>T4,
故选D.
点评: 本题考查化学平衡的影响因素以及化学平衡的计算知识,属于综合知识的考查,注意根据平衡移动原理分析解答,题目难度不大.
3、下列说法正确的是( )
A. 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
B. 某物质在熔融态能导电,则该物质中一定含有离子键
C. N2和Cl2两种分子中,每个原子的外层都具有8电子稳定结构
D. MgF2晶体中的化学键是共价键
【知识点】化学键
【答案】
【答案】C
【解析】A.干冰是分子晶体,其溶于水生成碳酸的过程克服分子间作用力,由于发生化学变化,还克服化学键,故A错误;B.金属单质在熔融状态时能导电,金属中含有金属键,所以某物质在熔融态能导电,则该物质中不一定含有离子键,故B错误;C.N2中N原子中的外层电子为5,形成3个共用电子对,所以每个原子的外层都具有8电子稳定结构,Cl2中Cl原子中的外层电子为7,形成1个共用电子对,所以每个原子的外层都具有8电子稳定结构,故C正确;D.MgF2晶体中的化学键是离子键,故D错误;故选C。
点睛:本题考查了分子间作用力、晶体类型的判断、化学键等。本题的易错点和难点是C,注意把握8电子稳定结构的判断,化合物分子某元素的化合价的绝对值与其原子外层电子数之和等于8,则该元素的原子外层满足8电子的稳定结构;双原子单质分子,元素原子的外层电子数目与其在分子中形成的共价键的数目之和为8,则其外层满足8电子结构。












