
贵阳传媒生文化课补习中心列表?
1、 辅导了一段时间,自我感觉还挺不错的,不管怎样都感谢在新学补习的时间,老师们都很好,认真负责,非常谢谢刘老师的培养!
2、 孩子在这边学习了1.5个月的时间,无论是学习习惯,还是学习动力方面,都有了不小的改进。新学高考这边的老师,认真负责,责任心强。
3、 交通很方便,就在八里桥路那边,开车也很方便,现在上课的学生很多,需要提前预约,一定要预约,感觉里面的老师都特别忙,试听后感觉非常不错,孩子也特别喜欢,现在孩子在里面上正式课了,老师特别认真负责,孩子的变化也挺大的,非常不错,推荐推荐!
 贵阳传媒生文化课补习中心列表
贵阳传媒生文化课补习中心列表 【新学高考艺考生文化课补习班收费】
新学高考艺考生文化课补习班开设的班型有一对一、小班、中班,班型不一样,价格不一样
【精英学科教师团队】
学校老师均拥有多年高三补习一线教学经验,针对学生问题快速做出解决方案,然后迅速击破学科漏洞。
 贵阳传媒生文化课补习中心列表
贵阳传媒生文化课补习中心列表习题
1、下列叙述中正确的是 ( )
A.胶体属于纯净物
B.能与酸反应的氧化物一定是碱性氧化物
C.电离出的阳离子有H+的物质一定是酸
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
【知识点】电化学 胶体
【答案】
D
2、将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )
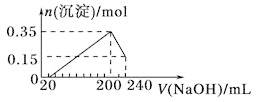
A. Mg和Al的总质量为8 g
B. 原稀硫酸溶液的物质的量浓度为5 mol·L-1
C. 生成的H2在标准状况下的体积为11.2 L
D. NaOH溶液的物质的量浓度为5 mol·L-1
【知识点】金属元素的单质及其化合物
【答案】
【答案】D
【解析】
试题分析:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O。当V(NaOH溶液)=200mL时,沉淀量大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4,从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由于从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,A.由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g,A错误;B.沉淀量大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于240mL氢氧化钠溶液中含有的n(NaOH)的1/2倍,所以n(Na2SO4)=1/2×0.2L×5mol/L=0.5mol,所以硫酸的浓度为0.5mol÷0.5L=1mol/L,B错误;C.由A中可知n(Al)=0.2mol,n(Mg)=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=0.9mol,所以n(H2)=0.45mol,故氢气体积为0.45mol×22.4mol/L=10.08L,C错误;D.由200~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.2mol,氢氧化钠的浓度为0.2mol÷(0.24L−0.2L)=5mol/L,D正确;答案选D。
【看到我】本题考查以图象题的形式考查镁铝的重要化合物、混合物计算等
【名师点晴】解答时注意分析图象各阶段的物质的量的关系,根据各阶段的化学反应,利用守恒计算。许多有关化学反应的计算,如果能够巧妙地运用守恒规律可以达到快速解题的目的,常见的守恒关系有:①反应前后元素种类和某种原子总数不变的原子守恒;②电解质溶液中的电荷守恒;③氧化还原反应中得失电子数守恒、原电池或电解池中两极通过的电子总数相等;④从守恒思想出发还可延伸出多步反应中的关系式,运用关系式法等计算技巧巧妙解题。
3、一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体体积的( )
A.
 B.
B.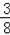
 C.
C.
 D.
D.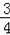

【知识点】硝酸
【答案】
【考点】化学方程式的有关计算.
【专题】利用化学方程式的计算.
【分析】假定的NO和O2体积分别为V,NO、O2与水发生反应4NO+3O2+2H2O=4HNO3,据此计算判断剩余气体及剩余气体的体积,据此解答.
【解答】解:假定的NO和O2体积分别为V,则:
4NO+3O2+2H2O=4HNO3,
4 3
V 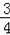
 V
V
故氧气剩余,剩余氧气为V﹣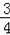
 V=
V=
 V,
V,
所以充分反应后剩余气体的体积缩小为原体积的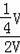
 =
=
 ,
,
故选A.
【点评】本题以一氧化氮和二氧化氮为载体考查了化学方程式的有关计算,难度不大,假设法是解化学题的常用方法,注意运用假设法解答即可.




















