
六盘水性价比高的艺考生文化课集训学校是哪家?
1、来这个学校已经有一段日子了,很喜欢这里的学习氛围,大家都是奔着考大学来这儿的,老师上课也很有趣,专业度更是毋庸置疑,在这里我也结识了很多爱学习的小伙伴,我们约定一定要一起考上理想的大学。
2、娃娃一到高三我们作为家长就要引起重视,之前就在网上咨询了这个学校,现在也去实地考察过了,什么都好,我们就果断把孩子送过来了,听说他在那边学习的很开心。
3、 在这里想跟众多家长说,小班的教学效果同样是有效的,关键是找到适合孩子方法的。孩子同样在新学高考学习,小班的效果更明显!
 六盘水性价比高的艺考生文化课集训学校是哪家
六盘水性价比高的艺考生文化课集训学校是哪家 【班型介绍】
一对一专属定制:针对性强,全程一对一跟踪辅导 教务团队全程七对一(1人)
基础提分班:零基础/中等生 小班(5人)
高分冲刺班:优等生 中班(9人)
【新学高考管理模式】
我们的老师会定期一对一与同学们进行沟通,让同学们树立信心,适当加压及增进动力,改进学习方法,制订目标;平时主题活动、体育活动、心理辅导保持备考阶段心态的平稳。
 六盘水性价比高的艺考生文化课集训学校是哪家
六盘水性价比高的艺考生文化课集训学校是哪家习题
1、下列实验设计能完成或实验结论合理的是 A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用浓硫酸吸收二氧化硫中混有少量SO3气体
【知识点】硝酸
【答案】
D
2、T℃,向5L恒容密闭容器中充入1molSO3气体,发生反应2SO3(g)⇌2SO2(g)+O2(g)
△H=+196kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量.当温度度不变时,改变某一条件,下列结论正确的是( )
| | 条件改变 | 结论 |
| A | 平衡后向容器中冲入1molHe | 平衡常数不变,混合气体的密度也不变 |
| B | 起始时向容器中冲入0.5molSO2、0.25molO2和2molSO3 | 反应达到平衡前v(正)>v(逆) |
| C | 起始时向容器中充入1molSO2和0.5mol O2 | 达到平衡时共放出78.4kJ的热量 |
| D | 起始时向容器中充入1molSO2和0.5molO2 | 达到平衡时,SO2的转化率为60% |
【知识点】化学平衡单元测试
【答案】
考点:
化学平衡建立的过程;化学平衡的影响因素. .
专题:
化学平衡专题.
分析:
A、恒容容器中加入惰气总压增大分压不变,平衡不动,平衡常数随温度变化,混合气体密度=;
B、充入2.0molSO3、0.50mol SO2和0.25mol O2 转化为起始量相当于充入2.5molSO3,相当于相同的平衡叠加,压强增大,平衡逆向进行;
C、充入1.0molSO2和0.50molO2 和充入1.0molSO3气体达到的平衡状态相同,依据平衡三段式计算;
D、依据平衡状态下计算得到平衡常数,结合化学平衡三段式列式计算.
解答:
解:A、平衡后向容器中充入1.0molHe,恒容容器中加入惰气总压增大分压不变,平衡不动,温度不变平衡常数不变化,加入氦气,气体质量增多,体积不变,密度增大,故A错误;
B、充入2.0molSO3、0.50mol SO2和0.25mol O2 转化为起始量相当于充入2.5molSO3,相当于相同的平衡叠加,压强增大,平衡逆向进行,反应达到平衡前v(正)<v(逆),故B错误;
C、依据平衡三段式计算
2SO3(g)⇌2SO2(g)+O2(g)△H=+196kJ/mol
起始量 1 0 0
变化量 0.2 0.2 0.1 19.6
平衡量 0.8 0.2 0.1
起始时向容器中充入1.0molSO2和0.50molO2,反应达到相同平衡,反应的二氧化硫物质的量为0.8mol,放热196KJ×0.4=78.4KJ,故C正确;
D、依据C计算平衡常数K=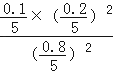 =0.00125;
=0.00125;
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196kJ/mol 平衡常数K=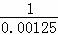 =800,假设按照转化率为60%计算平衡常数,反应的二氧化硫为0.12mol/L,
=800,假设按照转化率为60%计算平衡常数,反应的二氧化硫为0.12mol/L,
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.12 0.06 0.12
平衡量(mol/L) 0.08 0.04 0.12
K=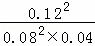 =56.25,不符合平衡常数,故D错误;
=56.25,不符合平衡常数,故D错误;
故选C.
点评:
本题考查化学平衡的分析判断,化学平衡的计算应用,平衡常数随温度变化,题目难度中等.
3、下列判断正确的是
A.在pH = 13的溶 液中,K+、Cl—、HCO3—、Ba2+可以大量共存
液中,K+、Cl—、HCO3—、Ba2+可以大量共存
B.在pH=0的溶液中,Na+、NO3—、Fe2+、K+可以大量共存
C.由0.1mol/L一元碱BOH溶液的pH=10,可知:BOH=B++OH—
 D.由0.1 mol/L一元酸HA溶液的pH=3,可知:A—+ H2O HA+ OH—
D.由0.1 mol/L一元酸HA溶液的pH=3,可知:A—+ H2O HA+ OH—
【知识点】离子反应
【答案】
B











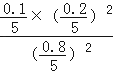 =0.00125;
=0.00125;







