
清镇艺术生文化课辅导中心推荐?
1、 孩子上高三以后成绩就不怎么跟得上,学起来很吃力,知识点掌握不到位,我平时也忙到上班,之前也在其他机构补过课,效果不是很好,后来到了新学高考,老师很认真的帮我们孩子分析了现在娃娃的学习情况,找出了现在娃娃存在的问题,我感觉这里的老师挺负责的,就报了一期班课,每次课后班主任都会给我反馈娃娃上课的情况,这会儿明显感觉娃娃成绩有了提升。
2、 学习氛围不错,自习室很安静,适合孩子学习,老师态度很好,针对孩子个性特点上课,对孩子课后习题进行讲解,时常反馈孩子的学习状况,考试前会进行考前复习,对孩子叮嘱关心,孩子学习效果理想,孩子喜欢在这儿上课,喜欢老师们。
3、 孩子本身就挺爱学习的需要有个氛围会更加的激进学习离家比较近这学习氛围不错留意了来培训的孩子都蛮不错的老师的教学跟指导也有耐心希望孩子学习能更上一步!
 清镇艺术生文化课辅导中心推荐
清镇艺术生文化课辅导中心推荐 新学高考艺考生文化课补习班开设班型
艺考生可选择的班型:根据学生和家长意愿,结合实际情况开设小班和中班。
艺考生报名地点及方式:成华区新学大厦学校招生办。登录学校官网,填写报名信息
【新学高考师资介绍】
新学高考的教师团队是一支创新与传统相结合的师资队伍。既有多年高考班的教学经验,也深知现在学生的心理特征,符合现在高考艺考生对老师的要求,在学习上既是严师也能与学生和谐的相处,让学生乐于在这样的环境中学习。考大学,就来新学高考!助你圆梦高考
 清镇艺术生文化课辅导中心推荐
清镇艺术生文化课辅导中心推荐习题
1、在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为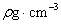 ,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
①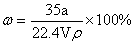 ②
②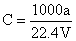
③上述溶液中加入V mL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
【知识点】物质的量浓度
【答案】
B
2、下列叙述正确的是( )
A.铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快
B.构成原电池的正极和负极必须是两种不同的金属
C.在铁上镀铜时,金属铜作阴极
D.用惰性电极电解CuSO4溶液,溶液的pH不变
【知识点】电化学 胶体
【答案】
【考点】CA:化学反应速率的影响因素;BH:原电池和电解池的工作原理.
【分析】A.Fe和硫酸铜发生置换反应生成Cu,Fe、Cu和稀硫酸构成原电池,原电池加快反应速率;
B.构成原电池的正负极可能是金属和导电的非金属;
C.电镀时,镀层作阳极、镀件作阴极;
D.用惰性电极电解CuSO4溶液,阳极上生成氧气、阴极上生成Cu,溶液中有氢离子生成.
【解答】解:A.Fe和硫酸铜发生置换反应生成Cu,Fe、Cu和稀硫酸构成原电池,原电池加快反应速率,所以铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快,故A正确;
B.构成原电池的正负极可能是金属和导电的非金属,如Fe、C和稀硫酸构成的原电池,故B错误;
C.电镀时,镀层作阳极、镀件作阴极,所以在铁上镀铜时,金属铜作阳极、Fe作阴极,故C错误;
D.用惰性电极电解CuSO4溶液,阳极上生成氧气、阴极上生成Cu,溶液中有氢离子生成,溶液中氢离子浓度增大,溶液的pH降低,故D错误;
故选A.
3、向某FeBr2溶液中,通入1.12 L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3 mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1 mol/L
B.反应后溶液中c(Fe3+)=0.1 mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4 mol/L
【知识点】重要的氧化剂和还原齐剂
【答案】
解析:当n(FeB r2)∶n(Cl2)≥2∶1时,反应为:6FeBr2+3Cl2===2FeCl3+4FeBr3此种情况下n(Br-)/n(Cl-)≥2∶1;当n(FeBr2)∶n(Cl2)≤2∶3时,反应为2FeBr2+3Cl2===2FeCl3+2Br2,溶液中没有Br-;由此可知,当c(Br-)=3c(Cl-)时,说明通入Cl2不足,发生前者的反应,且Fe2+没有完全被氧化。由前者反应化学方程式可知c(Cl-)=0.1 mol/L时,c(Fe3+)=0.1 mol/L。0.05 mol Cl2反应后n(Cl-)=0.1 mol,所以V(aq)=1 L。n(Br-)=0.3 mol,原溶液c(FeBr2)=0.15 mol/L,被氧化的Fe2+是0.1 mol,所以反应后c(Fe3+)=2c(Fe2+)。
r2)∶n(Cl2)≥2∶1时,反应为:6FeBr2+3Cl2===2FeCl3+4FeBr3此种情况下n(Br-)/n(Cl-)≥2∶1;当n(FeBr2)∶n(Cl2)≤2∶3时,反应为2FeBr2+3Cl2===2FeCl3+2Br2,溶液中没有Br-;由此可知,当c(Br-)=3c(Cl-)时,说明通入Cl2不足,发生前者的反应,且Fe2+没有完全被氧化。由前者反应化学方程式可知c(Cl-)=0.1 mol/L时,c(Fe3+)=0.1 mol/L。0.05 mol Cl2反应后n(Cl-)=0.1 mol,所以V(aq)=1 L。n(Br-)=0.3 mol,原溶液c(FeBr2)=0.15 mol/L,被氧化的Fe2+是0.1 mol,所以反应后c(Fe3+)=2c(Fe2+)。
答案:B











