
贵阳好的高三文化课冲刺中心?
1、 数学课程老师讲得很细致,思路很清晰,之前在学校听得一知半解的现在通过老师的讲解都弄懂了,老师很负责亲和力很强,我很喜欢在这里学习
2、孩子现在高三了,我们也没时间管理孩子的学习,就听亲戚的建议,给孩子找了一家全日制的培训学校,学校管理也是全封闭式管理,开始找了几家都没合适,刚好朋友就在教育机构上班,就给我推荐新学高考,了解之后感觉还可以,就没让孩子在学校读书了,直接去培训学校上课,效果还不错,孩子成绩也有所提升。
3、去年孩子高考前几次诊断成绩都不不理想,在班级里才30多名,但是想着万一高考超长发挥呢。结果高考落榜了,这个时候才恍然大悟不能拿孩子的前途开玩笑。所以立即给孩子找补习学校。很幸运,我们找到了新学高考。新学高考的老师还是很给力的,给我孩子针对性的补习。后面孩子成绩提升很快,尤其是成绩差的科目,在一个月内,提升了好几十分。
 贵阳好的高三文化课冲刺中心
贵阳好的高三文化课冲刺中心 【高考艺考生文化课补习班型介绍】
一对一个专属定制(1人)
精品小班(5人 )
基础中班(9人)
新学高考管理模式
吃住一体化的全日制模式
班主任全天监督,定期向家长汇报学生情况
课表安排严格按照高中学校时间表
定期的心理疏解课
 贵阳好的高三文化课冲刺中心
贵阳好的高三文化课冲刺中心习题
1、25℃,NaOH溶液pH为a,某酸溶液pH为b,a+b=14,a≥11.将两种溶液按等体积混合,下列说法正确的是()
A. 混合溶液的pH必定为7
B. 混合溶液的pH≤7
C. 向混合溶液中加入MgCl2溶液,可能生成Mg(OH)2沉淀
D. 混合溶液中可能有两种溶质
【知识点】水的电离和溶液的PH
【答案】
考点: pH的简单计算.
专题: 电离平衡与溶液的pH专题.
分析: 溶液的酸碱度可用pH值表示,其计算公式为pH=﹣lg〔H+〕,其中c〔H+〕表示氢离子浓度,25℃,NaOH溶液pH为a,c(H+)=1.0×10﹣amol•L﹣1,c(OH﹣)=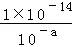 mol/L=1.0×10a﹣14mol•L﹣1,c(NaOH)=1.0×10a﹣14mol•L﹣1,
mol/L=1.0×10a﹣14mol•L﹣1,c(NaOH)=1.0×10a﹣14mol•L﹣1,
某酸溶液pH为b,c(H+)=1.0×10﹣bmol•L﹣1,酸未知,可为强酸、弱酸、一元酸、多元酸,若为一元弱酸,c(酸)>1.0×10﹣bmol•L﹣1,a+b=14,pH=b=14﹣a,a≥11,b≤3,
将两种溶液按等体积混合,设体积都为1L,n(H+)≥1.0×10﹣bmol,n(OH﹣)=1.0×10a﹣14mol,
A.若酸是弱酸,将两种溶液按等体积混合,溶液呈酸性;
B.若酸是弱酸,将两种溶液按等体积混合,酸过量;
C.将两种溶液按等体积混合,无论酸属于何种类型,碱全部中和;
D.根据酸为强酸、弱酸两种类型分析.
解答: 解:溶液的酸碱度可用pH值表示,其计算公式为pH=﹣lg〔H+〕,其中c〔H+〕表示氢离子浓度,25℃,NaOH溶液pH为a,c(H+)=1.0×10﹣amol•L﹣1,c(OH﹣)=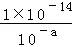 mol/L=1.0×10a﹣14mol•L﹣1,c(NaOH)=1.0×10a﹣14mol•L﹣1,
mol/L=1.0×10a﹣14mol•L﹣1,c(NaOH)=1.0×10a﹣14mol•L﹣1,
某酸溶液pH为b,c(H+)=1.0×10﹣bmol•L﹣1,酸未知为强酸、弱酸、一元酸、多元酸,若为一元弱酸,c(酸)>1.0×10﹣bmol•L﹣1,a+b=14,pH=b=14﹣a,a≥11,b≤3,
A.将两种溶液按等体积混合,设体积都为1L,n(H+)=1.0×10﹣bmol,b=14﹣a,n(H+)=1.0×10a﹣14mol,n(OH﹣)=1.0×10a﹣14mol,若酸为强酸,混合后PH=7,若为弱酸,混合后酸过量,pH>7,故A错误;
B.根据A分析,酸为强酸,混合后pH=7,若为弱酸,混合后酸过量,pH>7,故B正确;
C.将两种溶液按等体积混合,若酸为强酸,酸碱恰好中和,酸碱无剩余,若为弱酸,混合后酸过量,碱无剩余,所以无论酸性强弱,碱都无剩余,向混合溶液中加入MgCl2溶液,无Mg(OH)2沉淀生成,故C错误;
D.若为弱酸,混合后酸过量,混合溶液中有两种溶质:多余的弱酸和生成的盐,若为强酸,只有生成的盐一种,故D正确;
故选BD.
点评: 本题考查了溶液pH的计算,题目难度中等,理清溶液酸碱性与溶液pH关系为解答本题的关键,注意弱酸在溶液中部分电离的特点,试题有利于培养学生的分析、理解能力及化学计算能力.
2、为了检验Na2SO3中是否混有Na2SO4,应选用的试剂是( )
A.BaCl2溶液 B.BaCl2溶液和稀盐酸
C.BaCl2溶液和稀硝酸 D.BaCl2溶液和稀硫酸
【知识点】硫酸
【答案】
解析 A项中BaSO3也不溶于水;C项中HNO3会把BaSO3氧化生成BaSO4;D项中H2SO4和BaCl2反应生成BaSO4。
答案 B
3、下列离子方程式书写正确的是( )
A. Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O32- + 6H+ =2S↓ +3H2O
B. 向饱和Na2CO3溶液中通入过量CO2,2Na+ + CO32-+CO2+H2O═2 NaHCO3↓
C. Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O
D. Ba(OH)2与等物质的量 NaHSO4混合:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
【知识点】离子反应
【答案】
【答案】B
【解析】
【详解】A.Na2S2O3溶液与稀H2SO4反应为氧化还原反应,S的化合价一部分升高,一部分降低,离子方程式:S2O32-+2H+═S↓+SO2↑+H2O,故A错误;
B.因为Na2CO3溶液是饱和的,通入过量CO2,发生反应:Na2CO3+CO2+H2O═2NaHCO3,生成的NaHCO3会析出,离子方程式为CO32-+H2O+CO2+2Na+=2 NaHCO3↓,故B正确;
C.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:4时发生反应:Fe+NO3-+4H+═Fe3++NO↑+2H2O,n(Fe):n(HNO当3)=3:8时发生反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O,所以当n(Fe):n(HNO3)=1:2时应该生成Fe3+和Fe2+,故C错误;
D.Ba(OH)2与等物质的量NaHSO4混合,反应方程式为:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,离子方程式为:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故D错误。
故选B。
【点睛】判断离子方程式书写正误的方法:
“一看”电荷是否守恒:在离子方程式中,两边的电荷数及原子数必须守恒; “二看”拆分是否恰当:在离子方程式中,强酸、强碱和易溶于水的盐拆分成离子形式;难溶物、难电离物质、易挥发物质、单质、氧化物、非电解质等均不能拆分,要写成化学式;“三看”是否符合客观事实:离子反应的反应物与生成物必须是客观事实相吻合。



















