 贵阳音乐生文化课培训
贵阳音乐生文化课培训 贵阳音乐生文化课培训如何选学校?
1、 胡老师的课,非常有趣,非常关心孩子,我们孩子学习英语一直找不到方法,基本上没及过格,跟随胡老师学习小半年后,学习上产生了浓厚的兴趣,找到了正确的学习方法,学习习惯有了很大的改变。
2、 第一次过来是同事推荐,他的孩子在这里学习,进步挺明显,说推荐让我过来看看,我周末带着孩子过来了解,这个机构是试听双向选择,我们可以去选择老师,不是说来了就随便给我一个老师,孩子试听觉得不错,尤其是老师会对孩子学习情况进行反馈,还有给出解决办法,这个给我们孩子明确的学习方向,孩子学不好我一直不知道为什么,就想让他学好,但不知道怎么弄,老师说了我才明白是为什么,这个感觉就很好。
3、开始对培训机构很不信任,感觉老师要么是大学刚毕业的,要么就是到处找的兼职老师。直到了解到新学高考的老师,发现都是省级重点中学出来的教师,而且不管多优秀的教师只要是兼职都不要,只要全职的教师。
 贵阳音乐生文化课培训如何选学校
贵阳音乐生文化课培训如何选学校 新学高考艺考生文化课补习班:
新学高考艺考生课程主要是为高考成绩不理想的学生开设。新学高考针对艺考生的同学各个科目都进行辅导而且根据艺考生同学的具体学习情况来定制学习方案。新学高考教师在学习过程中帮助艺考生进行全面的查漏补缺,夯实艺考生的学习基础。新学高考将会在辅导过程中教会艺考生众多的答题技巧和学习干货,来帮助学生从容应对高考,终帮助艺考生实现升学的目标。
【新学高考师资介绍】
上课老师均是一线名师,在知识体系梳理、学习方法讲解、解题技巧讲授,缓解学生的心理压力方面都具备极高的专业水平,使学生全身心应对考试,帮助想上名校的学子顺利考上理想大学。
 贵阳音乐生文化课培训如何选学校
贵阳音乐生文化课培训如何选学校贵阳音乐生文化课培训习题
1、在下列条件下,能大量共存的微粒组是( )
| 化学式 | 电离常数 |
| CH3COOH | Ki=1.7×10﹣5 |
| HClO | Ki=3.0×10﹣8 |
| H2CO3 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
A.c(H+)=1×10﹣14mol/L的溶液:K+、Na+、AlO2﹣、S2O32﹣
B.右表提供的数据下:HClO、HCO3﹣、ClO﹣、CO32﹣
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3﹣、I﹣
D.中性的溶液中:CO32﹣、Na+、SO42﹣、AlO2﹣
【知识点】离子反应
【答案】
【考点】离子共存问题.
【专题】离子反应专题.
【分析】A.c(H+)=1×10﹣14mol/L的溶液,显碱性;
B.由表中的数据可知,酸性HClO>CO32﹣;
C.与Al反应生成H2的溶液,为非氧化性酸或强碱溶液;
D.中性溶液中不能存在水解显碱性的离子.
【解答】解:A.c(H+)=1×10﹣14mol/L的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.由表中的数据可知,酸性HClO>CO32﹣,二者发生强酸制取弱酸的反应,不能共存,故B错误;
C.与Al反应生成H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能存在NH4+,酸溶液中NO3﹣、I﹣(或Al)发生氧化还原反应,不能共存,故C错误;
D.CO32﹣、AlO2﹣均水解显碱性,与中性溶液不符,故D错误;
故选A.
【点评】本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,选项BD为解答的关键,注意选项B中表格数据的应用,题目难度不大.
2、对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸根
B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO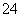
C.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
D.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
【知识点】离子反应
【答案】
C
3、下图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图。开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B。以下结论正确的是
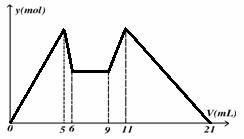
A.A可能是NaOH,B可能是盐酸,且2 c(A)=c(B)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶2∶7
C.A可能是Ba(OH)2,B可能是硫酸,且c(A)=2c(B)
D.若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B
【知识点】镁和铝
【答案】
【答案】D
【解析】
试题分析:A选项,根据加入量与沉淀溶解关系图可知,先加入的a为NaOH,之后加入的b为酸,并根据5-6ml沉淀溶解应为Al(OH)3+OH-=AlO2-+2H2O,物质的量之比为1:1;9-11ml生成沉淀为AlO2-+H++H2O=Al(OH)3,物质的量之比为1:1。故二者的浓度比 c(A)=2c(B)。故A错误。B选项,从加入5 mL A生成沉淀多,再继续加1 mL A沉淀量减少到小值,相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×6×10-3)mol;由前5 mL NaOH形成大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3) mol;溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故B错误。C选项,若a为Ba(OH)2 ,b为硫酸,则6-9ml阶段应该有沉淀量的变化,但题中无变化,故C错误。D选项正确。若A和B均为一元强酸或一元强碱,根据二者的浓度比 c(A)=2c(B),故D正确。
考点:镁、铝的重要化合物












